Перейти к:
Микробиоценоз влагалища у новотельных коров в климатических условиях Удмуртии
https://doi.org/10.23947/2949-4826-2025-24-1-39-48
EDN: UZIZNK
Аннотация
Введение. Высокое распространение воспалительных процессов в организме новотельных коров, а также неконтролируемое использование антибактериальных средств и рост резистентности к ним у возбудителей заболеваний вынуждает исследователей продолжать искать новые методы и средства профилактики и лечения. Одним из важных направлений в этой области является изучение конкурентных взаимодействий микрофлоры животных. При анализе различных научных источников установлено влияние множества факторов на формирование бактериальных сообществ в половом тракте коров, поэтому нашим научным интересом стало изучение микробиома влагалища у новотельных коров в климатических условиях Удмуртской Республики с учетом их физиологического статуса и сезонности.
Материалы и методы. Исследование проведено на животноводческом предприятии Удмуртской Республики в 2023–2024 гг. Объектом послужили 12 новотельных коров черно-пестрой голштинизированной породы с разным физиологическим статусом: здоровые коровы и животные с диагнозом метрит. При проведении исследования использовали комплекс методов: вагинальное исследование коров, микробиологическое исследование влагалищных смывов по общепринятой методике.
Результаты исследования. У клинически здоровых новотельных коров общее количество микроорганизмов находилось в пределах 87–94 КОЕ/мл, у больных метритом коров данный показатель варьировался в пределах 90–443 КОЕ/мл. При проведении микробиологического исследования влагалища у всех опытных животных выявлена ассоциация микрофлоры, представленная кишечной палочкой, стафилококком и бифидобактериями. В летний период у больных животных выявлено большое количество E. сoli, тогда как в зимний период обнаружили преимущественно бактерии рода Staphylococcus. В результате конкурентных взаимоотношений между бифидобактериями и условно-патогенной микрофлорой во влагалище, в летний период количество представителей семейства Bifidobacteriaceae незначительно (101) или полностью отсутствует.
Обсуждение и заключение. Установлена взаимосвязь между клиническим статусом и сезонностью вагинальной микрофлоры у новотельных коров, выращиваемых в климатических условиях Удмуртии. Для разработки эффективных пробиотических препаратов для профилактики цервицита и метрита у коров необходимы дальнейшие научные исследования.
Для цитирования:
Князева М.В., Бабинцева Т.В., Ильин Е.В. Микробиоценоз влагалища у новотельных коров в климатических условиях Удмуртии. Ветеринарная патология. 2025;24(1):39-48. https://doi.org/10.23947/2949-4826-2025-24-1-39-48. EDN: UZIZNK
For citation:
Knyazeva M.V., Babintseva T.V., Ilyin E.V. Vaginal Microbiocenosis of Newly-calved Cows in Climatic Conditions of Udmurtia. Russian Journal of Veterinary Pathology. 2025;24(1):39-48. (In Russ.) https://doi.org/10.23947/2949-4826-2025-24-1-39-48. EDN: UZIZNK
Введение. Различные микроорганизмы образуют микробиоценозы в системах организма, являясь симбионтной микрофлорой и синтезируя различные вещества для обменных процессов или защиты животных и человека. В послеродовой период в организме самки должно произойти четыре сопутствующих процесса до наступления следующей беременности: инволюция матки, регенерация эндометрия, восстановление циклирования яичников и контроль патогенных бактерий в матке [1]. Послеродовые заболевания матки связаны с выделением болезнетворных бактерий, в частности Escherichia coli, Trueperellapyogenes, Fusobacteriumnecroforum, Prevotella и Bacteroides. Причем данные микроорганизмы присутствуют в матке и во время беременности, но численность их невелика. В послеродовой период бактерии могут проникать в матку из влагалища, кожи и окружающей среды, а также попадать гематогенным путем, вызывая снижение фертильности или приводя к бесплодию [1–3].
Слизистая оболочка влагалища здоровой коровы заселена уравновешенным и динамичным составом аэробных, факультативно-анаэробных и облигатно-анаэробных микробов. Комменсальная микробиота играет ключевую роль в защите половых путей от патогенных микробов путем конкурентного воздействия [4]. Наиболее многочисленными бактериальными типами у голштино-фризского скота были представители Tenericutes, Firmicutes и Bacteroidetes. Затем в порядке уменьшения численности выявлены — Proteobacteria, Actinobacteria, Fusobacteria, Epsilonbacteraeota и Patescibacteria [5–8]. Также сообщается о еще двух родах, которых ранее не обнаруживали во влагалище молочных коров: Gallibacterium и Mannheimia [9].
По данным другого исследования у крупного рогатого скота наиболее распространены представители Bacteroidetes, Fusobacteria и Proteobacteria в половых путях. Коровы без маточных инфекций имеют во влагалище 15 таксонов, преимущественно Bacteroides и Enterobacteriaceae, а также Victivallis, Streptococcus, Phyromonadaceae, Alistipes, Coriobacteriaceae, Clostridium, Betaproteobacteria, Corynebacterineae, Cytophagaceae, Oscillibacter и Planctomycetaceae. Коровы с репродуктивными заболеваниями, характеризующимися гнойными выделениями из влагалища, имеют более разнообразный вагинальный микробиом, содержащий 68 таксонов, с преобладанием Bacteroides, Enterobacteriaceae, Histophilus, Alistipes, Flavobacteriaceae, Victivallis, Coriobacteriaceae, Streptococcus, Barnesiella и Oscillibacter [10]. Разница в выявляемых представителях микробиоценоза может быть связана с различиями в породе и возрасте изучаемых видов животных, их периоде эстрального цикла, географических условиях проживания, режиме питания и содержания [5][11].
Молочнокислые бактерии представляют собой большую группу разнообразных грамположительных бактерий, продуцирующих молочную кислоту. Она выступает в качестве основного конечного продукта ферментации углеводов, поэтому бактерии очень устойчивы к кислой pН среде [12]. Лактобактерии являются частью микробиоценоза влагалища в норме, которая вызывает местную иммунную реакцию [13–15]. Наличие на слизистой оболочке достаточного количества лактобактерий — важный фактор, обеспечивающий корректный уровень местных иммунных механизмов. Кроме того, выделяемая в процессе обмена веществ этих микроорганизмов молочная кислота поддерживает слабокислую pH во влагалище, что обуславливает защиту от колонизации слизистой оболочки разными условно-патогенными и патогенными микроорганизмами. Помимо этого, палочки Дедерляйна продуцируют перекись водорода, которая, являясь мощным окислителем, оказывает неспецифическое бактерицидное действие [16].
Ученые обнаружили, что представители Lactobacillus spp. преобладают в микробиоте коров, хотя и в низкой концентрации, редко превышая 1 % влагалищного микробиоценоза (в отличие от женщин, относительное количество лактобактерий во влагалище у которых обычно больше 70 %) [15]. Таким образом, они связали почти нейтральный рН, фиксируемый во влагалище коровы, с низкой численностью этого рода бактерий [2][16]. Микробиоту влагалища у животных можно разделить на пять основных типов состояния сообщества, в четырех из них преобладают лактобациллы. В I группе преобладает вид Lactobacillus crispatus, во II группе — L. gasseri, в III группе — L. iners и в IV группе — L. jensenii. В IV группе нет доминирования лактобацилл, но присутствует множество более строгих анаэробов [17].
Ранее было установлено, что вагинальные лактобациллы в дозе 10⁸–10⁹ КОЕ/мл способны снижать частоту гнойных выделений из влагалища, ускорять инволюцию матки и снижать частоту внутриутробных инфекций у молочных коров в перинатальный период [16]. Чаще при терапии используют штаммы лактобактерий. Однако существуют данные, что обаутопробиотические и гомологичные крысиные штаммы бифидобактерий при введении снижали популяцию стафилококков быстрее, чем в случае использования лактобацилл, однако при этом отмечали рецидивы заболеваний [18]. Бифидобактерии обладают широким набором факторов адгезии, что позволяет им успешно конкурировать в борьбе за сайты связывания на слизистой с патогенными и условно-патогенными микроорганизмами [19]. Помимо антагонистической активности бифидобактерии также обладают и антиоксидантной активностью: максимальные антиоксидантные свойства бифидобактерии проявляли при рН 5,78 [20].
Анализ различных научных источников по теме показал влияние множества факторов на формирование бактериальных сообществ в половом тракте коров, поэтому мы решили сосредоточиться на изучении и анализе микробиома влагалища у коров, проживающих в климатических условиях Удмуртской Республики, в зависимости от их физиологического статуса и сезонности.
Материалы и методы. Исследование проведено в 2023–2024 гг. на одном из животноводческих предприятий Удмуртской Республики. Объектом исследования стали новотельные коровы черно-пестрой голштинизированной породы. Всего исследовано 12 коров со среднесуточным удоем 22–29 л, с количеством лактаций 1–3, в возрасте 4–5 лет.
Для оценки структуры болезней исследуемого поголовья предварительно проведен ретроспективный анализ заболеваемости стада на основании ветеринарных отчетов предприятия.
Животных эксперимента наблюдали с 1-го по 7-й дни после отела в разные сезоны года (лето и зима). Для этого проводили осмотр слизистой оболочки влагалища с интервалом в два дня с соблюдением правил асептики, для осмотра использовали влагалищное зеркало с осветительным прибором и эндоскоп для визуального осеменения коров. Оценивали следующие показатели: цвет слизистой оболочки, наличие кровоизлияний, повреждений, характеристика лохий.
Для проведения микробиологического исследования на 4–5-й день наблюдения отбирали смывы со слизистой оболочки дорсолатеральной стенки влагалища. Использовали стерильную ватную палочку, которую помещали в транспортную среду Эймса. Микробиологическое исследование проводили путем посева смывов на мясо-пептонный агар (МПА), солевой агар для выделения стафилококков, среду Эндо, Клиглера и Бифидум. Культивировали в термостате при температуре 37 ºС в течение 1–3 суток, далее подсчитывали количество выросших колоний, описывали их и затем изготавливали мазки, окрашивая их по Граму согласно общепринятой методике. Микроскопию мазков осуществляли на микроскопе «БиоЛам» (АО «ЛОМО», Россия) с использованием иммерсионного объектива, ув. ×1000.
Результаты исследования. Анализ заболеваемости исследуемого стада за 2023 г. помог оценить степень распространения акушерско-гинекологических заболеваний у новотельных коров — данная группа болезней преобладает среди всех регистрируемых заболеваний в стаде и составляет 68,8 %. При этом структура акушерско-гинекологической группы болезней выглядит следующим образом: 44,4 % — болезни яичников, 41,6 % — метрит, 14 % — задержание последа.
В летний период результаты осмотра слизистой оболочки влагалища в первый день после отела характеризуются гиперемией в 55,5 % случаев. Кровоизлияния и повреждения слизистой оболочки влагалища отсутствуют. Выделения, обнаруживаемые на слизистой оболочке влагалища, также схожи у большинства коров и представляют собой густую мутную слизь с желтоватым оттенком и включениями разного цвета — красного, белого, серого. На 4-й день наблюдения у 16,6 % коров зафиксированы жидкие зловонные выделения, характерные для гнилостного метрита. В другом случае 16,6 % животных имели выделения в виде густой темно-красной слизи со слабым неприятным запахом, характерные для гнойно-катарального метрита. Коровы с физиологическим течением послеродового периода преобладали в исследовании — 66,6 %. Половина из них имела слизистые прозрачные выделения с незначительными включениями красного цвета, другая половина — только прозрачные слизистые выделения.
В зимний период уже на 4-5-й день после отела консистенция выделений изменялась: в 83 % случаев они становились жидкими. Цвет выделений и включений в них отличались разнообразием — от белого и розового цвета до желтого и коричневого. Зловонный запах присутствовал у 16,6 % исследуемых коров. Таким образом, в зимний период выделены коровы с гнилостным (22,2 %) и гнойно-катаральным метритом (44,4 %). Выделения животных с отсутствием осложнений послеродового периода были слизистыми, темно-красного цвета, но имели разжиженную консистенцию.
Для оценки микробиома влагалища смывы высевали на питательные среды (МПА, среду Эндо, Клиглера, солевой агар, среда Бифидум). На среде Эндо отмечали рост колоний малинового цвета, диаметром от 1 до 4 мм, округлой формы, с гладкой поверхностью, ровными краями (риc. 1а). При микроскопии находили грамотрицательные палочки (рис. 1б). Проводили пересев на среду Клиглера, где через 24 ч после инкубации наблюдали изменение цвета среды на желтый цвет и газообразование (рис. 2). Полученные результаты указывают на наличие кишечной палочки (E. coli).

Рис. 1. Результаты посевов смывов с влагалища новотельных коров:
а — рост E. coli на среде Эндо; б — E. coli в мазках, ув. ×1000

Рис. 2. Рост E. coli на среде Клиглера
На солевом агаре отмечен рост колоний диаметром от 1 до 5 мм, белого цвета, выпуклых, с ровным краем и гладкой поверхностью. При микроскопии визуализировали грамположительные кокки, формирующие скопление неправильной формы (рис. 3). Это указывает на наличие бактерий рода Staphylococcus.
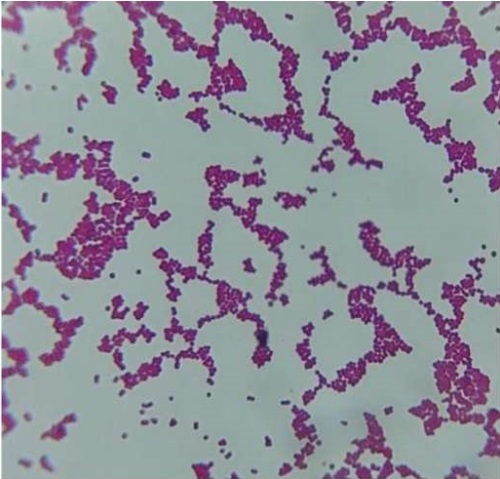
Рис. 3. Бактерии рода Staphylococcus на солевом агаре, ув. ×1000
На мясо-пептонном агаре обнаружено большое количество разнообразных колоний. При проведении визуальной оценки выявили колонии белого цвета, неправильной формы, с ровными краями и гладкой поверхностью, диаметром до 4 мм. Также были обнаружены плоские, складчатые колонии ризоидной формы серовато-белого цвета с коричневым оттенком, диаметром до 2 см. При микроскопии двух образцов с разных колоний обнаружены грамположительные палочки, представленные бациллами (рис. 4).
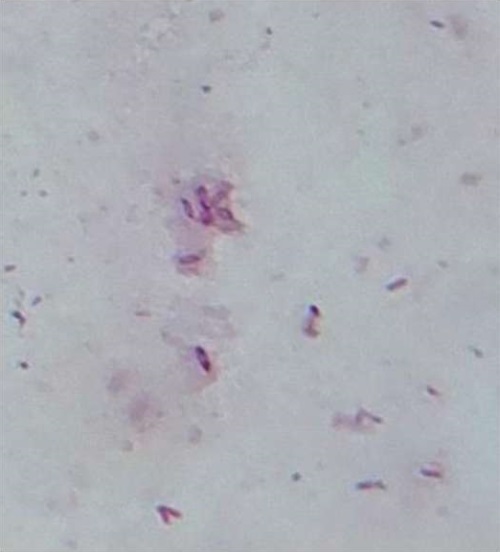
Рис. 4. Грамположительные бациллы на мясо-пептонном агаре, ув. ×1000
На среде Бифидум отмечался рост в виде «комет», «гвоздиков», «зерен» различной степени четкости (рис. 5). В мазках визуализировались грамположительные палочки, слегка изогнутые, в виде скоплений.

Рис. 5. Рост бактерий семейства Bifidobacteriaceae на среде Бифидум:
а — в виде «зерен»; б — в виде «комет»
Количество мезофильных аэробных и факультативных анаэробных микроорганизмов (КМАФАнМ) в исследуемых группах в летний и зимний периоды было примерно одинаковым (таблица 1). Можно отметить, что содержание бактерий рода Staphylococcus было выше летом, относительно зимы, в 6,5 раз. У отдельных животных данный показатель составлял 44 КОЕ/мл, а в зимний период количество бактерий варьировалось от 1 до 11 КОЕ/мл. Аналогичная ситуация с кишечной палочкой, содержание которой в летний период было выше зимнего в 9 раз. В летнем периоде исследования только у 16,6 % коров присутствовал рост бифидобактерий в разведении 10¹. В зимнем же исследовании у 83,3 % коров наблюдали рост бифидобактерий в разведении 10⁷, у 16,6 % — в разведении 10⁴. Таким образом, в среднем зимой количество бактерий семейства Bifidobacteriaceae увеличивается относительно летнего периода до 10⁷ КОЕ/мл.
Таблица 1
Микробиологические показатели влагалищных смывов (n=12) у новотельных коров, КОЕ/мл
Виды микроорганизмов | Клинически здоровые (n=6 гол.) | Больные метритом (n=6 гол.) | ||
Летний период | Зимний период | Летний период | Зимний период | |
КМАФАнМ | 87,3±57,8 | 94,0±13,0 | 443,3±249,4 | 90,0±11,9 |
Staph. ssp. | 26,0±10,1 | 4,0±3,5 | 8±1,5 | 49,3±26,9 |
E. coli | 9,0±5,0 | 1,0±0,3 | 446,3±437,8 | 1,0±0,3 |
Bifid. ssp. | 10¹ | 10⁶ | - | 10⁷ |
У коров, больных метритом, в летний период КМАФАнМ был на уровне 443 КОЕ/мл, что в 4,9 раза больше относительно зимы. Содержание бактерий летом варьировалось от 13 до 877 КОЕ/мл, а зимой — от 68 до 109 КОЕ/мл.
У больных животных в летний период из условно-патогенных регистрировалось больше E. coli, чем в зимний период, и данный показатель составлял 446,3±437,8 КОЕ/мл. Так, у одной из коров с острым метритом в летний период количество кишечной палочки по сравнению с другими животными составило 1322 КОЕ/мл, также общее количество бактерий относительно других животных — 877 КОЕ/мл.
В зимний же период наблюдали повышение количества бактерий рода Staphylococcus в 6 раз по сравнению с летними данными. У одной коровы с острым метритом количество бактерий рода Staphylococcus составило 103 КОЕ/мл относительно других животных, у которых данный показатель был на уровне 20–25 КОЕ/мл.
У коров, больных острым метритом, в летний период количество микроорганизмов составляло 443 КОЕ/мл, что на 80,3 % больше, чем у здоровых коров. Также данный показатель был выше на 79,6 %, чем у больных животных в зимний период.
В летний период содержание бактерий рода Staphylococcus выше у клинически здоровых коров, но можно отметить, что количество кишечной палочки выше у животных с метритом. В зимний период отмечается другая тенденция: бактерий кишечной палочки в обеих группах на одном уровне, а стафилококков больше у животных с метритом (49 КОЕ/мл).
Обсуждение и заключение. Проведенное исследование показало, что представители нормофлоры, а также условно-патогенной микрофлоры присутствуют на слизистой оболочке влагалища как больных метритом коров, так и здоровых (рис. 6). Поэтому основная масса работ, посвященных изучению микрофлоры влагалища коров, ориентирована на определение ее роли в этиологии, разработку диагностических подходов и оценку эффективности лечения акушерской патологии [12][21].
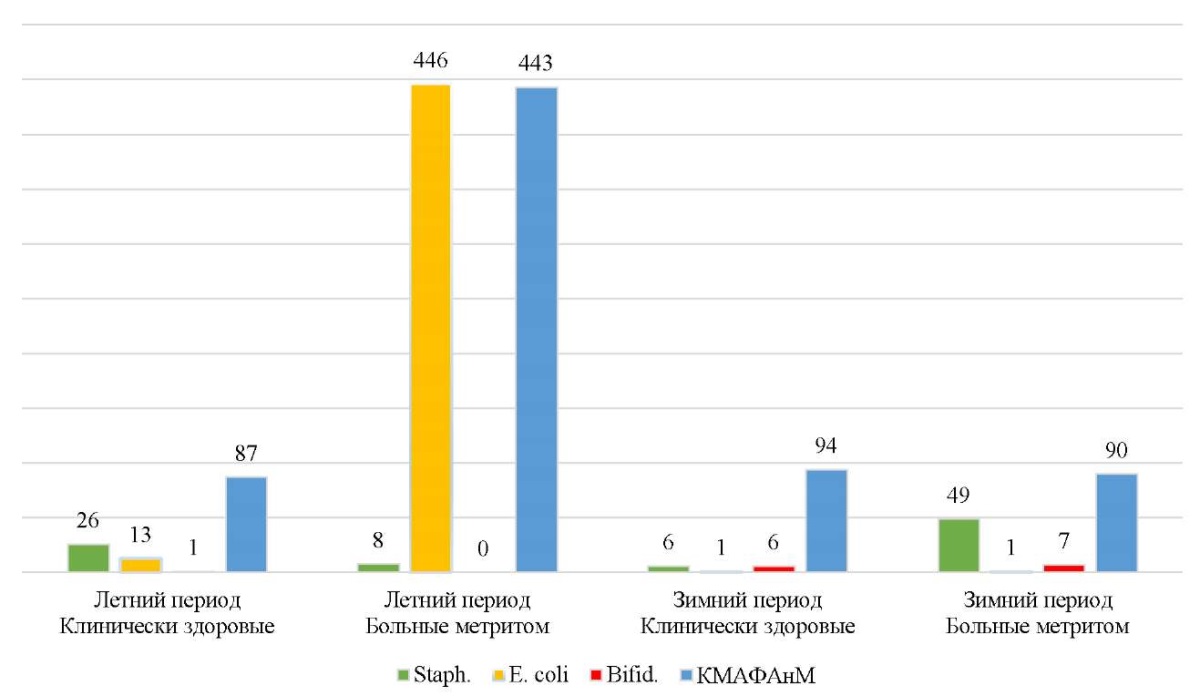
Рис. 6. Соотношение микроорганизмов на слизистой оболочке влагалища у новотельных коров, КОЕ/мл
У коров с физиологическим течением послеродового периода отметили присутствие бактерий рода Staphylococcus и E. coli. В летний период количество данных микроорганизмов выше (26,0±10,1 КОЕ/мл и 9,0±5,0 КОЕ/мл соответственно), чем зимой (4,0±3,5 КОЕ/мл и 1,0±0,3 КОЕ/мл соответственно), что обусловлено более благоприятными условиями для сохранения бактерий во внешней среде. У любой самки молочного и мясного скота после отела увеличивается бактериальное разнообразие матки, но лишь у части развиваются субклинические или клинические заболевания [9]. Защита полости матки со стороны влагалища и шейки матки способствует снижению разнообразия микробиома матки. При этом высокое разнообразие микробиоты влагалища по сравнению с маткой объясняется ее близостью к внешней среде [22].
В зимний период в исследуемом стаде чаще наблюдали изменения выделений из половых путей, характерные для метрита, однако как в летний, так и в зимний период типы экссудата при воспалительных процессах совпадали. При этом во влагалище в 55,5 % случаев отмечали гиперемию слизистой оболочки, но воспалительный процесс не наблюдался. Можно отметить изменение содержания условно-патогенных микроорганизмов на слизистой влагалища. Так, летом увеличивается количество кишечной палочки относительно стафилококков, это можно объяснить их конкуренцией между собой. Зимой данный показатель снижается, как и у здоровых животных, что указывает на неблагоприятные условия для E. coli в данный период, при этом бактерии рода Staphylococcus начинают превалировать над кишечной палочкой.
Также выделили распространенную группу симбионтных микроорганизмов, которые относят к домену Bacteria, типу Actinobacteria, классу Actinobacteria, порядку Bifidobacteriales, семейству Bifidobacteriaceae, роду Bifidobacterium [19]. Отмечено наличие антагонистического взаимодействия между бифидобактериями и кишечной палочкой. Летом содержание бактерий рода Bifidobacterium было низким, а зимой их содержание увеличивалось, при этом количество E. coli уменьшалось.
Некоторые из наиболее важных механизмов действия симбионтных микроорганизмов, которые приносят пользу хозяину, включают: усиление барьерных функций эпителия; образование биопленок на слоях слизистой оболочки; предотвращение адгезии возбудителей; конкуренцию за основные питательные вещества; производство противомикробных соединений; модуляцию иммунной системы; изменение рН влагалища [2][13][22].
Антагонистический эффект бифидобактерий обусловлен продукцией ими, в ходе своей жизнедеятельности, молочной и уксусной кислот, которые, в свою очередь, снижают рН, препятствуя развитию патогенных и условно-патогенных микроорганизмов. Помимо кислот, бифидобактерии в процессе своего роста и развития накапливают и продуцируют антимикробные вещества — бактериоцины (бифидин, бифилонг), которые также оказывают бактерицидное и бактериостатическое действие на патогенную микрофлору [20].
На состав влагалищной микрофлоры влияют различные факторы. В нашем случае можно отметить, что на такое разнообразие и количество микроорганизмов повлияла температура окружающей среды, условия содержания, несоблюдение санитарно-гигиенических условий при родовспоможении. У животных с метритом выявили увеличение количества условно-патогенных микроорганизмов на слизистой оболочке влагалища: в зимний период это были бактерии рода Staphylococcus, летом — E. coli. Данные результаты подтверждаются, тем, что летом экссудат носил катаральный характер, а зимой регистрировали преимущественно гнойные выделения.
Миграция микрофлоры по половому тракту в вышерасположенные органы по отношению к влагалищу возможна в случаях открытия цервикального канала. Данная ситуация складывается при состояниях течки и охоты во время полового цикла, во время родов и ранний послеродовой период. Поэтому в эти периоды возможна активная миграция микрофлоры как из влагалища в матку, так и в обратном направлении [8].
Понимание функциональной роли бактериальных сообществ в репродуктивных путях крупного рогатого скота позволяет получить важные данные для объяснения взаимосвязи этих факторов с плодотворным осеменением животных. Кроме того, полученные результаты позволяют находить новые, более экологичные варианты терапии и профилактики заболеваний репродуктивного тракта.
Список литературы
1. Sheldon I, Owens SE. Postpartum Uterine Infection and Endometritis in Dairy Cattle. Animal Reproduction. 2017;14(3):622–629. http://dx.doi.org/10.21451/1984-3143-AR1006 https://doi/10.21451/1984-3143-AR1006
2. Rosales EB, Ametaj BN. Reproductive Tract Infections in Dairy Cows: Can Probiotics Curb Down the Incidence Rate? Dairy. 2021;2(1):40–64. https://doi.org/10.3390/dairy2010004
3. Gonzalez MC, Torres LA, Oliszewski R, Rosa RJ, Otero MC. Characterization of Native Escherichia Coli Populations from Bovine Vagina of Healthy Heifers and Cows with Postpartum Uterine Disease. PLoS ONE. 2020;15(6):e0228294. https://doi.org/10.1371/journal.pone.0228294
4. Srinivasan M, Adnane M, Archunan G. Significance of Cervico-Vaginal Microbes in Bovine Reproduction and Pheromone Production – A Hypothetical Review. Research in Veterinary Science. 2021;135:66–71. https://doi.org/10.1016/j.rvsc.2021.01.003
5. Quereda JJ, Barba M, Mocé ML, Gomis J, Jiménez-Trigos E, García-Muñoz Á, et al. Vaginal Microbiota Changes during Estrous Cycle in Dairy Heifers. Frontiers in Veterinary Science. 2020;7:371. https://doi.org/10.3389/fvets.2020.00371
6. Messman RD, Contreras-Correa ZE, Paz HA, Perry G, Lemley CO. Vaginal Bacterial Community Composition and Concentrations of Estradiol at the Time of Artificial Insemination in Brangus Heifers. Journal of Animal Science. 2020;98(6): skaa178. https://doi.org/10.1093/jas/skaa178
7. Miranda-CasoLuengo R, Lu J, Williams EJ, Miranda-CasoLuengo AA, Carrington SD, Evans ACO, et al. Delayed Differentiation of Vaginal and Uterine Microbiomes in Dairy Cows Developing Postpartum Endometritis. PLoS ONE. 2019;14(1):e0200974. https://doi.org/10.1371/journal.pone.0200974
8. Малик Н.И., Малик Е.В., Маленкова Л.А., Русанов И.А., Гагаева Е.А. Изоляция, идентификация и пробиотические свойства влагалищных изолятов молочнокислых бактерий здоровых сухостойных коров. Аграрная наука. 2021;(10):27–31. https://doi.org/10.32634/0869-8155-2021-353-10-27-31
9. Bicalho MLS, Santin T, Rodrigues MX, Marques CE, Lima SF, Bicalho RC. Dynamics Of the Microbiota Found in the Vaginas of Dairy Cows during the Transition Period: Associations with Uterine Diseases and Reproductive Outcome. Journal of Dairy Science. 2017;100:3043–3058. https://doi.org/10.3168/jds.2016-11623
10. Аdnane М, Chapwanya А. A Review of the Diversity of the Genital Tract Micrbiome and Implications for Fertility of Cattle. Animals. 2022;12(4):460. https://doi.org/10.3390/ani12040460
11. Mariadassou M, Nouvel LX, Constant F, Morgavi DP, Rault L, Barbey S, et al. Microbiota Members from Body Sites of Dairy Cows are Largely Shared within Individual Hosts throughout Lactation but Sharing is Limited in The Herd. Animal Microbiome. 2023;5:32. https://doi.org/10.1186/s42523-023-00252-w
12. Appiah М.О., Wang J., Lu W. Microflora in the Reproductive Tract of Cattle: A Review. Agriculture. 2020;10(6):323. https://doi.org/10.3390/agriculture10060232
13. Cheng C, Tian Q, Su S, Zhang H, Guo H, Gao P, et al. Isolation and Screening of Lactic Acid Bacteria Strains with Antibacterial Properties from the Vagina of Healthy Cows. Open Journal of Animal Sciences. 2022;12(3):390–406. https://doi/10.4236/ojas.2022.123030
14. Коба И.С., Новикова Е.Н. Сравнение схем профилактики эндометритов у коров с применением антибиотиков и пробиотиков. Ветеринарный фармакологический вестник. 2019;(1(6)):19–24. https://doi.org/10.17238/issn2541-8203.2019.1.19
15. Кузьмин В.Н., Стома И.О., Адамян Л.В. Микробиом в акушерстве и гинекологии: переоценка взглядов на микробное сообщество репродуктивной системы. Инфекционные болезни: новости, мнения, обучение. 2020;9(2):94–98. https://doi.org/10.33029/2305-3496-2020-9-2-94-98
16. García-Galán A, Dela Fe C, Gomis J, Bataller E, Sanchez A, Quereda JJ, et al. The Addition of Lactobacillus Spp. Negatively Affects Mycoplasma Bovis Viability in Bovine Cervical Mucus. BMC Veterinary Research. 2020;16:251. https://doi.org/10.1186/s12917-020-02454-9
17. Попов Д.В. Микробиота и репродукция у сельскохозяйственных видов млекопитающих (обзор). Сельскохозяйственная биология. 2022;57(2):222–236. https://doi.org/10.15389/agrobiology.2022.2.222rus
18. Ермоленко Е.И., Пунченко О.Е., Воропаева Л.С., Сварваль А.В., Котылева М.П., Суворов А.Н. Пробиотики и аутопробиотики в терапии экспериментального вагинита. Антибиотики и химиотерапия. 2022;67(11–12):29–35. https://doi.org/10.37489/0235-2990-2022-67-11-12-29-35
19. Захарова Ю.В., Леванова Л.А. Современные представления о таксономии, морфологических и функциональных свойствах бифидобактерий. Фундаментальная и клиническая медицина. 2018;3(1):90–101. https://doi/10.23946/2500-0764-2018-3-1-90-101
20. Функ И.А., Иркитова А.Н. Биотехнологический потенциал бифидобактерий. Acta Biologica Sibirica. 2016;2(4):67–79. http://doi.org/10.14258/abs.v2i4.1707
21. Паршин П.А., Востроилова Г.А., Бригадиров Ю.Н., Шапошников И.Т., Жуков М.С., Манжурина О.А. и др. Микробный пейзаж половых путей здоровых коров с различным сроком стельности. Международный вестник ветеринарии. 2023;(4):431–437. https://doi.org/10.52419/issn2072-2419.2023.4.431
22. Clemmons BA, Reese ST, Dantas FG, Franco GA, Smith TPL, Adeyosoye OI, et al. Vaginal and Uterine Bacterial Communities in Postpartum Lactating Cows. Frontiers of Microbiology. 2017;8:1047. https://doi.org/10.3389/fmicb.2017.01047
Об авторах
М. В. КнязеваРоссия
Мария Владимировна Князева, кандидат ветеринарных наук, доцент кафедры анатомии и физиологии
426069, Удмуртская Республика, г. Ижевск, ул. Студенческая, д. 11
Т. В. Бабинцева
Россия
Татьяна Викторовна Бабинцева, кандидат ветеринарных наук, доцент кафедры эпизоотологии и ветеринарно-санитарной экспертизы
426069, Удмуртская Республика, г. Ижевск, ул. Студенческая, д. 11
Е. В. Ильин
Россия
Евгений Васильевич Ильин, аспирант кафедры анатомии и физиологии
426069, Удмуртская Республика, г. Ижевск, ул. Студенческая, д. 11
В исследовании микробиома влагалища новотельных коров выявлены сезонные изменения микрофлоры. У здоровых коров общее число микроорганизмов колебалось от 87 до 94 КОЕ/мл. В группе с метритом данный показатель варьировался от 90 до 443 КОЕ/мл. Летним временем наблюдается преобладание кишечной палочки, в зимний период – стафилококка. Необходимы дальнейшие исследования для разработки пробиотиков для профилактики заболеваний.
Рецензия
Для цитирования:
Князева М.В., Бабинцева Т.В., Ильин Е.В. Микробиоценоз влагалища у новотельных коров в климатических условиях Удмуртии. Ветеринарная патология. 2025;24(1):39-48. https://doi.org/10.23947/2949-4826-2025-24-1-39-48. EDN: UZIZNK
For citation:
Knyazeva M.V., Babintseva T.V., Ilyin E.V. Vaginal Microbiocenosis of Newly-calved Cows in Climatic Conditions of Udmurtia. Russian Journal of Veterinary Pathology. 2025;24(1):39-48. (In Russ.) https://doi.org/10.23947/2949-4826-2025-24-1-39-48. EDN: UZIZNK


























