Перейти к:
H₂S-зависимые механизмы экспрессии и локализации каспазы-3 в клетках головного мозга мышей при черепно-мозговой травме
https://doi.org/10.23947/2949-4826-2025-24-2-19-28
EDN: HPMRMX
Аннотация
Введение. Черепно-мозговая травма (ЧМТ) является распространенной нейротравмой среди животных. ЧМТ вызывает сложный каскад патологических процессов: первичное повреждение мозга переходит во вторичное, связанное с воспалением, окислительным стрессом, эксайтотоксичностью и апоптозом. Вторичное повреждение усугубляет состояние после травмы. В этой связи особый интерес представляет роль газотрансмиттера сероводорода (H₂S), который участвует в нейромодуляции, противовоспалительных, антиоксидантных и антиапоптотических процессах в центральной нервной системе. Важным элементом апоптоза при ЧМТ является каспаза-3. H₂S потенциально может модулировать экспрессию и активность каспазы-3, влияя на выживание нервных клеток и восстановление мозга после ЧМТ. Однако H₂S-зависимые механизмы регулирования каспазы-3 при травматическом повреждении до конца не изучены. Цель статьи — исследовать роль H₂S в экспрессии и локализации каспазы-3 в нейронах и астроцитах головного мозга мышей при ЧМТ.
Материалы и методы. Исследования проводились на кафедре «Биоинженерия» ДГТУ (г. Ростов-на-Дону) в условиях, соответствующих международным и национальным стандартам, в период c 20 апреля по 1 июня 2024 г. Объект исследования — 36 взрослых самцов мышей, поделенных на три группы: контрольную и две экспериментальные. Моделирование ЧМТ проводилось путем сброса груза (200 г) на необнаженный череп под анестезией хлоралгидратом. Донор H₂S сульфид натрия (Na₂S), способный эффективно высвобождать H₂S, либо ингибитор (аминооксиуксусная кислота, AOAA) цистатионин-β-синтазы (CBS), фермента, ответственного за эндогенный синтез H₂S, — вводились ежедневно после ЧМТ в течение 7 дней до выведения животных из эксперимента. Использование Na₂S и AOAA позволяло эффективно модулировать уровень эндогенного Н₂S в головном мозге. Контрольной группе вводили физиологический раствор. Срезы мозга, фиксированные в 4 % PFA, инкубировались с антителами к каспазе-3 и нейрональному ядерному маркеру NeuN либо к астроцитарному маркеру GFAP. Колокализация оценивалась с помощью программы ImageJ. Анализ экспрессии каспазы-3 проводился в пенумбре мозга методом вестерн-блота с использованием первичных антител к каспазе-3 и β-актину и вторичных антител IgG, конъюгированных с пероксидазой хрена, детекция — хемилюминесцентным методом.
Результаты исследования. Изначальный уровень каспазы-3 в клетках головного мозга исследуемых мышей был низким. ЧМТ индуцировала экспрессию каспазы-3 в нейронах и глиальных клетках ипсилатерального поврежденного полушария через 7 дней во всех группах после травмы. Использование донора Na₂S приводило к снижению уровня каспазы-3 в нейронах на 32 %, тогда как ингибитор AOAA вызывал его увеличение на 31 % относительно травмированных нервных клеток контрольной группы, которой вводили физиологический раствор, об этом свидетельствуют показатели коэффициента M1 колокализации каспазы-3-положительных клеток с маркером нейрональных ядер NeuN. Аналогичные эффекты были продемонстрированы и на астроцитах, которые визуализировались с помощью специфичного астроцитарного маркера GFAP. Вестерн-блот анализ подтвердил эти данные, показывая значительное снижение уровня каспазы-3 при использовании Na₂S и его увеличение при введении AOAA через 7 дней после ЧМТ.
Обсуждение и заключение. Результаты исследования демонстрируют, что ЧМТ приводит к значительной активации каспазы-3 в нейронах и астроцитах поврежденного полушария головного мозга мышей, отражая развитие апоптоза в ответ на травматическое повреждение. Применение Na₂S эффективно снижало уровень каспазы-3, указывая на его нейропротекторное и антиапоптотическое действие. В то же время введение AOAA индуцировало увеличение экспрессии каспазы-3, подтверждая важную роль CBS и, соответственно, H₂S в регуляции клеточной гибели после ЧМТ. Надежность этих наблюдений была подтверждена как иммуногистохимически, так и методом вестерн-блот анализа. Полученные данные помогут лучше понять фундаментальные H₂S-зависимые сигнальные механизмы выживания и гибели нейронов и глиальных клеток при травматическом повреждении нервной системы, а ингибитор CBS и донор H2S, использованные в нашем исследовании, могут лечь в основу разработки клинически эффективных нейропротекторных препаратов.
Ключевые слова
Для цитирования:
Родькин С.В., Кириченко Е.Ю. H₂S-зависимые механизмы экспрессии и локализации каспазы-3 в клетках головного мозга мышей при черепно-мозговой травме. Ветеринарная патология. 2025;24(2):19-28. https://doi.org/10.23947/2949-4826-2025-24-2-19-28. EDN: HPMRMX
For citation:
Rodkin S.V., Kirichenko E.Yu. H₂S-Dependent Mechanisms of Caspase-3 Expression and Localization in Brain Cells of Mice with Traumatic Brain Injury. Russian Journal of Veterinary Pathology. 2025;24(2):19-28. https://doi.org/10.23947/2949-4826-2025-24-2-19-28. EDN: HPMRMX
Введение
Черепно-мозговая травма (ЧМТ) является одной из самых распространенных причин смерти и инвалидности среди животных. ЧМТ приводит к сложному каскаду патофизиологических процессов, включая первичное механическое повреждение ткани мозга и последующее вторичное повреждение, обусловленное воспалением, окислительным стрессом, эксайтотоксичностью и апоптозом. Вторичное повреждение, развивающееся после травмы, играет ключевую роль в прогрессировании тяжести состояния, привлекая значительное внимание ученых всего мира, стремящихся найти эффективные стратегии лечения и нейропротекторные препараты [1–3].
В последние годы растет интерес к роли газотрансмиттеров, таких как сероводород (H₂S), в патофизиологии ЧМТ. H₂S, долгое время считавшийся исключительно токсичным газом, в настоящее время признан важной биологически активной молекулой, способной участвовать в ряде физиологических и патологических процессов, включая нейромодуляцию, сосудистую регуляцию, противовоспалительное действие и антиоксидантную защиту. В центральной нервной системе H₂S действует как нейромодулятор и нейропротектор, влияя на различные сигнальные пути, включая связанные с клеточной гибелью по типу апоптоза [4][5].
Одним из ключевых проапоптотических белков является каспаза-3 — эффекторная цистеин-содержащая протеаза, расщепляющая белки исключительно после аспартата и занимающая центральную позицию в реализации апоптоза. Было показано, что каспаза-3 может являться потенциальной мишенью для H₂S и его активных производных. Однако сведения о роли H₂S-зависимых механизмов в регулировании каспазы-3 носят противоречивый характер. В одних исследованиях было показано, что H₂S может уменьшать экспрессию данного фермента [6–8], а в других научных работах демонстрируется H2S-зависимая экспрессия каспазы-3 и цитотоксический эффект [9–11]. Таким образом, механизмы, посредством которых H₂S влияет на экспрессию и локализацию каспазы-3 при ЧМТ, остаются малоизученными [9].
Целью настоящего исследования является изучение H₂S-зависимых механизмов регуляции каспазы-3 при ЧМТ. Мы предполагаем, что H₂S может оказывать модулирующее влияние на экспрессию и локализацию каспазы-3, тем самым воздействуя на интенсивность и продолжительность нейровоспалительного ответа при ЧМТ. Изучение этих механизмов позволит лучше понять сложный патогенез ЧМТ и открыть новые перспективы для разработки терапевтических стратегий, направленных на модуляцию нейровоспаления и улучшение восстановительных процессов в мозге.
Материалы и методы
Этическое одобрение
Все исследования были одобрены этическим комитетом ДГТУ, также они соответствовали международным требованиям по биоэтике.
Объект и процедуры
Исследования проводились в лаборатории «МедЦифра» факультета «Биоинженерия и ветеринарная медицина» кафедры «Биоинженерия» ДГТУ в период c 20 апреля по 1 июня 2024 г. В общей сложности в эксперимент было включено 36 взрослых самцов мышей CD-1, возраст которых составлял от 14 до 15 недель, а масса тела — 20–25 г. Мыши содержались в стандартных условиях вивария: в пластиковых клетках с подстилкой из опилок, при температуре 22 ± 2 °C, относительной влажности 50–60 % и 12-часовом свето-темновом режиме. Кормление осуществлялось стандартным гранулированным кормом для лабораторных грызунов, доступ к воде был свободным.
Мыши были разделены на три группы: контрольную, которой вводили физиологический раствор, и две экспериментальные, которым вводили инъекции донора Н2S сульфида натрия (Na₂S, 0,1 мг/кг; Khimikon, Россия), либо ингибитора цистатионин-β-синтазы (CBS) аминооксиуксусную кислоту (AOAA, 5,0 мг/кг; Tianjin Xidian Chemical Technology Co., Ltd., Китай), соответственно. Использование Na₂S и AOAA позволяло эффективно модулировать уровень эндогенного Н2S в головном мозге: Na₂S способен эффективно высвобождать H₂S; а AOAA — ингибитор CBS, фермента, ответственного за эндогенный синтез H₂S. Препараты вводились внутрибрюшинно после травмы в течение 7 дней ежедневно до выведения животных из эксперимента.
Для всех групп применялась одна модифицированная версия стандартного протокола для моделирования ЧМТ. Мыши получали анестезию путем внутрибрюшинной инъекции хлоралгидрата (300 мг/кг). Затем сбрасывался груз с высоты 3 см на необнаженный череп. Координаты сброса груза задавались как 2 мм дорсально от брегмы, 1 мм латерально от срединной линии. Удар осуществлялся устройством для сброса груза, которое представляло собой металлический стержень (с наконечником диаметром 3 мм, длиной 5 мм) весом 200 г. После пробуждения от наркоза мыши возвращались в свое обычное жилище [12].
Иммунофлуоресцентный анализ
Для идентификации локализации каспазы-3 через 7 дней после ЧМТ использовался следующий протокол. Извлекалась область вокруг очага некроза, вызванного ударом груза, а также из левого, неповрежденного полушария. Вырезанный кусочек коры головного мозга мыши фиксировали в 4 % PFA в течение 12 часов при температуре +4 °С с постоянным помешиванием. Далее с помощью автоматического микротома с вибрирующим лезвием Leica VT1000 S (Leica Biosystems Nussloch, Германия) были получены срезы толщиной 20 мкм. Для блокирования сайтов неспецифичного связывания срезы инкубировали 60 мин при температуре +24 °С в растворе, содержащем 5 % BSA и 0,3 % тритоном X-100.
Затем срезы инкубировали с первичными антителами аnti-CASP3 (1:100, Rabbit, AF6311, Affinity, Китай, антитело против каспазы-3) и anti-NeuN (1:1000, Mouse, FNab10266, Fine Test, Китай, антитело против ядерного белка NeuN) в течение 48 часов при температуре +4 °C. После многократной промывки в PBS срезы инкубировали с вторичными антителами anti-Rabbit IgG (H+L) Fluor 488-conjugated (1:500; S0018, Affinity Biosciences, Китай) и anti-Mouse IgG (H+L) Fluor 594-conjugated (1:500; S0005, Affinity Biosciences, Китай). Затем срезы заключали в глицерин, получая препараты для анализа на флуоресцентном микроскопе Альтами ЛЮМ 1 (Ningbo Haishu Honyu Opto-Electro Co., LTD, Китай совместно с компанией «Альтами», Россия), оснащенном цифровой камерой высокого разрешения EXCCD01400KPA (Hangzhou Toup Tek Photonics Co., Ltd., Китай).
Анализ колокализации каспазы-3 с NeuN осуществлялся с использованием специального пакетного обеспечения Image J, дополненным плагином JACoP [13]. Оценку среднего уровня флуоресценции каспазы-3 проводили на 10 фотографиях срезов для каждой мыши, опыта и контроля, по следующей формуле:

где Imean — средняя интенсивность в исследуемой области; Iback — средняя интенсивность фона.
Иммуноблоттинг
Исследование экспрессии каспазы-3 в условиях активации или ингибирования сигнального пути H2S в области пенумбры коры головного мозга мышей после ЧМТ было проведено методом вестерн-блота. Через 7 дней после травмы животные были декапитированы, извлечен мозг, и на льду с помощью цилиндрического ножа была удалена область инфаркта. Далее другим ножом было вырезано кольцо шириной 2 мм, соответствующее пенумбре. Эти кольца сравнивались с контрольными образцами из коры другой стороны мозга той же мыши. Образцы подвергали гомогенизированию в буфере для лизиса тканей, который был дополнен ингибиторами протеаз и фосфатаз. Далее полученный гомогенат центрифугировали для получения надосадочной жидкости. В супернатанте определяли концентрацию белка, используя метод Бредфорда. Затем в лунки в полиакриламидном геле вносили 25 мкг белка в 20 мкл и подвергали электрофорезу в присутствии додецилсульфата натрия. В качестве оборудования использовалась Mini-PROTEAN Tetra (Bio-Rad, США). После электрофореза белки переносились на нитроцеллюлозную мембрану методом полусухого переноса с помощью Trans-Blot Turbo Transfer System (Bio-Rad, США). Затем использовались первичные антитела против каспазы-3 (1:100, AF6311, Affinity, Китай) и β-актина и вторичное антитело кролика к иммуноглобулину IgG, конъюгированное с пероксидазой хрена (HRP) (1:1000; S0001, Affinity Biosciences, Китай). Затем проводили хемилюминесцентную детекцию белков. Для обнаружения хемилюминисценции использовали систему гель-документирования SH-Advance523 (Shenhua Science Technology Co., Ltd., Китай).
Статистический анализ
Для статистической обработки и анализа полученных результатов использовали метод однофакторного дисперсионного анализа. Парное множественное сравнение проводили с помощью критерия Тьюки. Параметрические критерии использовались при соблюдении правил нормальности и однородности дисперсий, которые оценивали с помощью теста Шапиро-Уилка и Брауна-Форсайта, соответственно. Если гипотеза о нормальности и гомогенности дисперсий не подтверждалась, использовался непараметрический критерий Краскела-Уоллиса. Статистически значимая достоверность считалась при р<0.05. Для статистического анализа использовался программный пакет SigmaPlot версии 12.5 (Systat Software, Inc., США).
Результаты
В результате иммунофлуоресцентной микроскопии было продемонстрировано, что каспаза-3 имеет локализацию в нервных и глиальных клетках. Их нуклеоплазма была визуализирована с помощью флуорохрома Hoechst 33342. Также колокализационный анализ показал, что каспаза-3 совместно обнаруживается с NeuN, ядерным белком нейронов, и GFAP, маркером астроцитов (рис. 1 a).
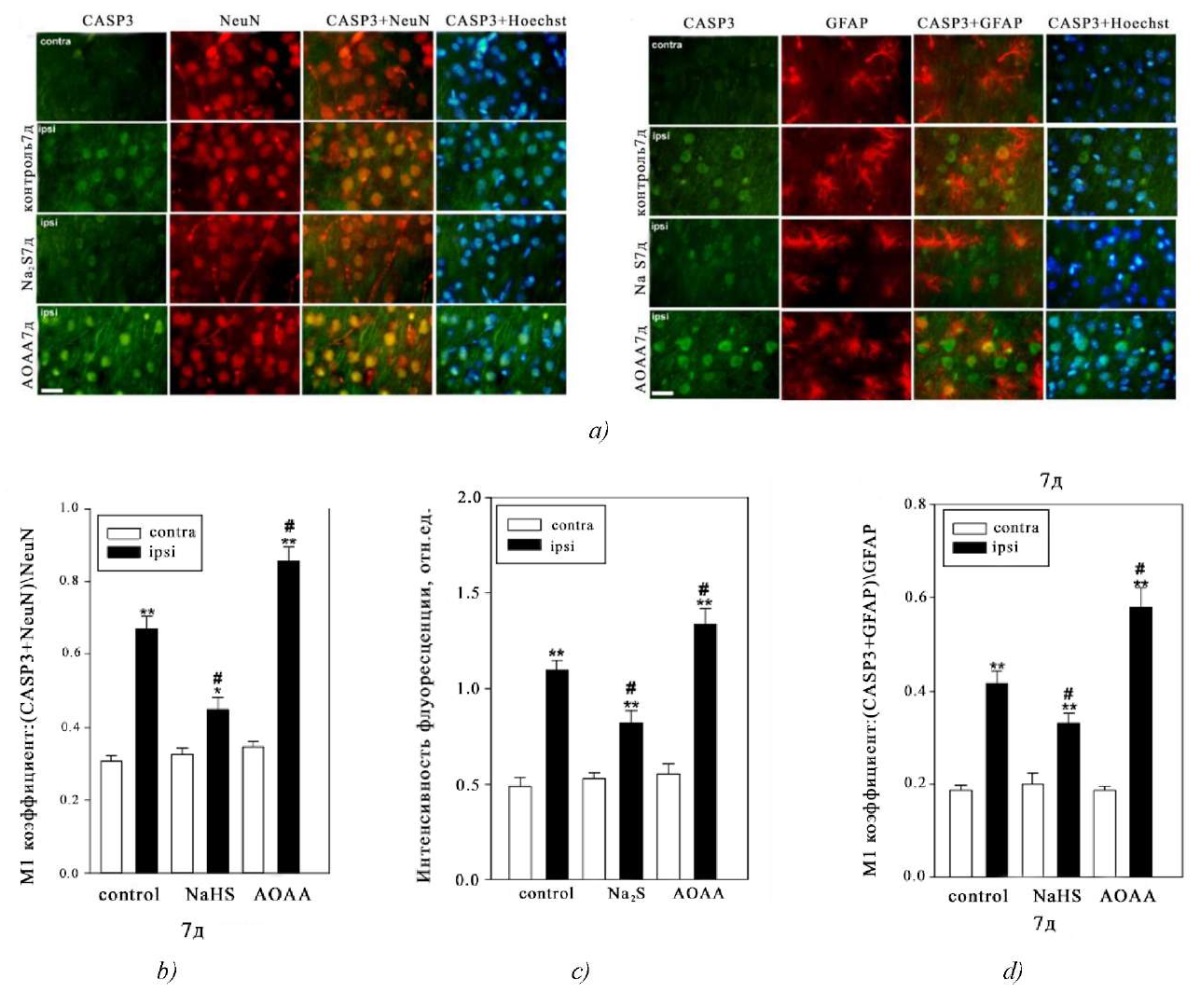
Рис. 1. Иммунофлуоресцентная микроскопия:
а — экспрессия каспазы-3 (Casp3, зеленая флуоресценция) в нейронах и астроцитах головного мозга мышей контрольной и экспериментальных групп через 7 суток после травмы. Масштабная линейка 20 мкм. NeuN — маркер ядер нейронов (красная флуоресценция); NeuN+Casp3 и Hoechst+Casp3 — колокализация. GFAP — маркер астроцитов (красная флуоресценция); GFAP+Casp3 и Hoechst+Casp3 — колокализация. Флуоресценция Hoechst — Hoechst 33342 (синяя флуоресценция), визуализирующий ядра всех клеток;
b — коэффициент M1 колокализации каспазы-3 и NeuN в контралатеральных и ипсилатеральных нейронах контрольной и экспериментальной групп через 7 суток после травмы;
c — зависимость средней интенсивности флуоресценции каспазы-3 в цитоплазме нервных клеток контралатеральной и ипсилатеральной коры контрольной и экспериментальных групп через 7 суток после травмы;
d — коэффициент M1 колокализации каспазы-3 и GFAP в астроцитах контралатеральной и ипсилатеральной коры контрольной и экспериментальной групп через 7 дней после ЧМТ. Contra — контралатеральная кора; Ipsi — ипсилатеральная кора. One-wayANOVA. М±SEM. n=6
Примечание: **p<0.05, **p<0.01 — ипсилатеральная кора относительно контралатеральной коры одного животного; #p<0.05 — ипсилатеральная кора мышей экспериментальной группы по сравнению с ипсилатеральной корой мышей контрольной группы в течение одного периода времени после травмы
При этом экспрессия каспазы-3 в нейронах ипсилатеральной и контралатеральной коры мозга мышей контрольной и экспериментальных групп значительно отличается. Это подтверждают результаты коэффициента М1, отражающего степень колокализации NeuN c целевым белком, а именно с каспазой-3. В контралатеральной коре уровень каспазы-3 был незначительным во всех группах на протяжении всех временных интервалов после моделирования ЧМТ. Однако травматическое воздействие приводило к быстрому росту экспрессии каспазы-3 в нейронах поврежденной зоны мозга относительно контралатеральной области в 2,2 раза через 7 дней после ЧМТ (p<0.01). Использование Na2S приводило к снижению уровня каспазы-3 на 32 % в ипсилатеральной коре относительно ипсилатерального полушария контрольной группы (p<0.05) (рис. 1 b).
Применение ингибитора CBS оказывало обратный эффект. Так через 7 суток после травмы значение коэффициента M1 каспазы-3 в поврежденных нейронах мозга животных, которым делали инъекцию AOAA, увеличился на 31 % (p<0.05) относительно поврежденных клеток контроля. Также экспрессия каспазы-3 увеличилась в 2,5 раза (p<0.01) в нервных клетках ипсилатерального полушария группы животных, которым делали инъекцию AOAA, относительно нейронов противоположного полушария этого же животного (рис. 1 b).
Анализ флуоресценции каспазы-3 в цитоплазме нейронов также показал, что уровень данного фермента увеличивается в поврежденных нервных клетках. Интенсивность флуоресценции в цитоплазме нейронов контрольной группы и экспериментальных животных, которым вводили Na2S и AOAA, увеличивалась в 2,7 раза (p<0.01), на 56 % (p<0.01), и в 2,4 раза (p<0.01) относительно контралатеральной коры, соответственно. При этом уровень каспазы-3 уменьшался в ипсилатеральной коре животных, которым вводили Na2S, и увеличивался в группе, которой вводили AOAA, относительно ипсилатеральной коры контроля на 26 % (p<0.05) и 21 % (p<0.05) через 7 дней после ЧМТ, соответственно (рис. 1 c).
Далее мы исследовали уровень каспазы-3 в астроцитах, которые идентифицировали с помощью специфического маркера GFAP. C помощью анализа колокализации нам удалось установить, что каспаза-3 экспрессируется в этом типе глиальных клеток после ЧМТ. Кроме этого, донор Na₂S и ингибитор AOAA оказывали противоположные эффекты на динамику экспрессии каспазы-3 в астроцитах после ЧМТ (рис. 1 d). Так было показано, что уровень данного фермента увеличивается в ипсилатеральной коре контрольной и экспериментальных групп, которым вводили Na2S и AOAA, относительно контралатеральной коры в 2,2 раза (p<0.01), 65 % (p<0.01), и в 3 раза (p<0.01), соответственно. Также уровень каспазы-3 уменьшался в ипсилатеральной коре животных, которым вводили Na2S, и увеличивался в группе, которой вводили AOAA, относительно ипсилатеральной коры контроля на 19 % (p<0.05) и 41 % (p<0.05) через 7 дней после ЧМТ, соответственно (рис. 1 c).
Данные флуоресцентной микроскопии подтверждают результаты, полученные в ходе вестерн-блот анализа общей фракции нервной ткани головного мозга контрольной и экспериментальных групп, которым вводили Na2S и AOAA (рис. 2).
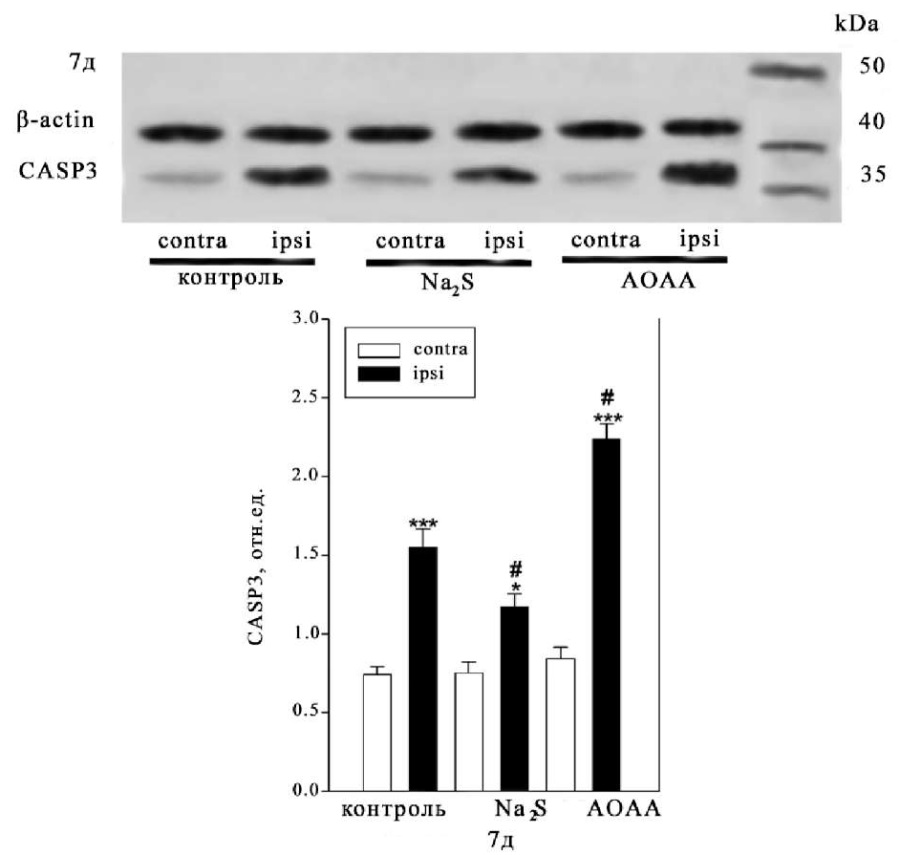
Рис. 2. Вестерн-блот. Экспрессия каспазы-3 в контралатеральной и ипсилатеральной коре контрольной и экспериментальных групп через 7 суток после травмы. One-way ANOVA. М±SEM. n=6
Примечание: *p<0.05, ***p<0.001 — ипсилатеральная кора относительно контралатеральной коры одного животного; #p<0.05 — ипсилатеральная кора экспериментальной группы по сравнению с ипсилатеральной корой контрольной группы в течение одного периода времени после травмы
Было показано, что экспрессия каспазы-3 через 7 дней после ЧМТ увеличивается в ипсилатеральной коре мозга животных контрольной и экспериментальных групп, которым вводили Na2S и AOAA, относительно контралатеральной коры в 2 раза (p<0.001), 36 % (p<0.05), и практически в 2,6 раза (p<0.001), соответственно. При этом экспрессия каспазы-3 в ипсилатеральной коре животных, которым вводили Na2S и AOAA, относительно ипсилатеральной коры контроля уменьшалась на 24 % (p<0.05) и увеличивалась на 44 % (p<0.05), соответственно (рис. 2).
Обобщая полученные результаты, можно заключить, что иммунофлуоресцентная микроскопия показала, что каспаза-3 колокализуется с маркерами нейрональных ядер NeuN и астроцитов GFAP в нейронах и глиальных клетках. В контрольной и экспериментальных группах наблюдались различия в экспрессии каспазы-3 между ипсилатеральной (поврежденной) и контралатеральной (неповрежденной) корой мозга. Травма приводила к значительному увеличению экспрессии каспазы-3 в нейронах и глиальных клетках поврежденной области через 7 дней после ЧМТ, что указывало на активацию апоптоза.
Использование донора Na₂S снижало уровень каспазы-3 в нейронах ипсилатеральной коры, а ингибитор AOAA вызывал противоположный эффект, увеличивая экспрессию каспазы-3. Аналогичные результаты были получены при изучении каспазы-3 в астроцитах, где наблюдалась повышенная экспрессия в группе с AOAA и пониженная в группе с Na₂S.
Вестерн-блот анализ общей фракции нервной ткани головного мозга контрольной и экспериментальных групп подтвердил результаты иммунофлуоресцентной микроскопии. Введение Na₂S снижало экспрессию каспазы-3 в поврежденной области, тогда как AOAA способствовало её увеличению. Эти данные свидетельствуют о важной роли H₂S в регуляции апоптоза в нейронах и глиальных клетках после ЧМТ.
Обсуждение
На сегодняшний день известно, что H2S может выступать в качестве мощного регулятора процесса апоптоза при нейротравмах. H2S-зависимые механизмы регулирования клеточной гибели исследовались на многих экспериментальных моделях с использованием разных доноров H2S и ингибиторов ферментов, ответственных за синтез H2S. Однако роль H2S-зависимых сигнальных механизмов в регулировании экспрессии и локализации каспазы-3 в нейронах и глиальных клетках при ЧМТ недостаточно изучены.
В нашем исследовании было показано, что H2S является важным звеном в контроле уровня каспазы-3 в клетках головного мозга в условиях индуцированной механической травмы, моделирующей ЧМТ. Интенсивность клеточной гибели при вторичном повреждении, вызванном ЧМТ, напрямую коррелирует с уровнем проапоптотических белков. Каспаза-3 является одним из ключевых белков апоптоза. Увеличение уровня данного протеолитического фермента свидетельствует об инициации процессов, ведущих к клеточной гибели. Примененные нами быстрый донор сероводорода Na2S и классический ингибитор ключевого фермента синтеза H2S в нервной ткани AOAA оказывали противоположные эффекты на экспрессию данного белка. Изначальный уровень каспазы-3 в неповрежденных нейронах и глиальных клетках головного мозга был низким. Однако через 7 дней после ЧМТ уровень каспазы-3 значительно увеличивался, особенно в нейронах, а также глиальных клетках. Использование Na2S позволяло снизить экспрессию данного фермента. Обратный эффект наблюдался в условиях ингибирования CBS с помощью AOAA.
H₂S регулирует уровень каспазы-3 через различные молекулярные механизмы, многие из которых связаны с его способностью влиять на антиапоптотические и антиоксидантные системы клеток. Одним из ключевых путей является повышение экспрессии белков семейства Bcl-2 [14], которые препятствуют активации каспаз, включая каспазу-3 [15]. Bcl-2 взаимодействует с проапоптотическими белками, такими как Bax и Bak, и предотвращает высвобождение цитохрома c из митохондрий. Это важный этап в процессе апоптоза, так как Cyt c участвует в формировании апоптосомного комплекса с Apaf-1 [16], который активирует каспазы и инициирует клеточную гибель. H₂S, повышая уровень Bcl-2, стабилизирует митохондриальные мембраны и препятствует апоптозу.
Кроме того, H₂S действует как мощный антиоксидант, эффективно снижая уровень активных форм кислорода (АФК), которые играют важную роль в индукции апоптоза через активацию каспаз [4][5][17][18]. Повышение уровня АФК вызывает повреждение митохондрий, что ведет к активации каспаз и последующей гибели клеток. Однако H₂S, обладая восстановительными свойствами, может напрямую нейтрализовать АФК, снижая их окислительный потенциал. Это уменьшает стресс на клеточные структуры, в том числе на митохондрии, и препятствует запуску каскада апоптоза. Более того, H₂S может активировать ряд антиоксидантных ферментов, таких как супероксиддисмутазы и каталазы, защищая клетки от избыточного уровня АФК [4][19].
H₂S также способен напрямую взаимодействовать с ферментом каспазой-3. Важно отметить, что в составе каспазы-3 содержится критически важный остаток цистеина, который может быть мишенью для модификации через персульфидирование — процесс, при котором H₂S присоединяет серу к тиоловой группе цистеина. Персульфидирование остатка цистеина 163 в активном центре каспазы-3 приводит к ингибированию её протеолитической активности, что предотвращает расщепление субстратов каспазы-3 и, соответственно, замедляет или останавливает апоптоз [20]. Это показывает, что H₂S может оказывать двойное действие на апоптоз: как опосредованно — через регуляцию антиапоптотических и антиоксидантных путей, — так и напрямую, ингибируя активацию каспаз.
Дополнительно H₂S может модулировать другие сигнальные пути, связанные с клеточной гибелью. Например, он может активировать сигнальный путь Nrf2 (ядерный фактор эритроидного 2-го типа), который является ключевым регулятором антиоксидантной защиты клеток. Nrf2 при активации запускает транскрипцию множества генов, отвечающих за антиоксидантную и цитопротекторную функции, тем самым снижая уровень оксидативного стресса и защищая клетки от апоптотического повреждения [21][22].
Также следует отметить, что H₂S может взаимодействовать с другими газотрансмиттерами, такими как оксид азота (NO) и угарный газ (CO), образуя комплексные сигнальные сети, которые регулируют клеточную выживаемость [23]. Синергетическое или антагонистическое взаимодействие H₂S с NO и CO может оказывать влияние на различные этапы апоптоза, включая активацию или ингибирование каспаз.
Таким образом, в нашем исследовании мы детально рассмотрели экспрессию и локализацию каспазы-3 в нейронах и астроцитах головного мозга при ЧМТ. Полученные в ходе исследования результаты носят как фундаментальное, так и практическое значение. Данные о роли H2S в регуляции ключевого проапоптотического белка каспазы-3 расширяют представления о внутриклеточных сигнальных процессах выживания и гибели клеток нервной системы, а AOAA и Na2S могут лечь в основу разработки клинически эффективных нейропротекторных препаратов.
Список литературы
1. Maas AIR, Menon DK, Manley GT, Abrams M, Åkerlund C, Andelic N, et al. Traumatic Brain Injury: Progress and Challenges in Prevention, Clinical Care, and Research. Lancet Neurology. 2022;21(12):1004–1060. https://doi.org/10.1016/S1474-4422(22)00309-X
2. Capizzi A, Woo J, Verduzco-Gutierrez M. Traumatic Brain Injury: An Overview of Epidemiology, Pathophysiology, and Medical Management. Medical Clinics of North America. 2020;104(2):213–238. https://doi.org/10.1016/j.mcna.2019.11.001
3. Ladak AA, Enam SA, Ibrahim MT. A Review of the Molecular Mechanisms of Traumatic Brain Injury. World Neurosurgery. 2019;131:126–132. https://doi.org/10.1016/j.wneu.2019.07.039
4. Rodkin S, Nwosu C, Sannikov A, Raevskaya M, Tushev A, Vasilieva I, et al. The Role of Hydrogen Sulfide in Regulation of Cell Death Following Neurotrauma and Related Neurodegenerative and Psychiatric Diseases. International Journal of Molecular Sciences. 2023;24(13):10742. https://doi.org/10.3390/ijms241310742
5. Rodkin S, Nwosu C, Sannikov A, Tyurin A, Chulkov VS, Raevskaya M, et al. The Role of Gasotransmitter-Dependent Signaling Mechanisms in Apoptotic Cell Death in Cardiovascular, Rheumatic, Kidney, and Neurodegenerative Diseases and Mental Disorders. International Journal of Molecular Sciences. 2023;24(7):6014. https://doi.org/10.3390/ijms24076014
6. Sun J, Li X, Gu X, Du H, Zhang G, Wu J, et al. Neuroprotective Effect of Hydrogen Sulfide against Glutamate-Induced Oxidative Stress Is Mediated via the p53/Glutaminase 2 Pathway after Traumatic Brain Injury. Aging. 2021;13(5):7180–7189. https://doi.org/10.18632/aging.202575
7. Zhang J, Zhang S, Shan H, Zhang M. Biologic Effect of Hydrogen Sulfide and Its Role in Traumatic Brain Injury. Oxidative Medicine and Cellular Longevity. 2020;2020(1):7301615. https://doi.org/10.1155/2020/7301615
8. Chen D, Fang Y-L, Zhang L-L, Niu X-Y, Sun X-R, Niu X-Z, et al. Hydrogen Sulfide Ameliorates Isoflurane-Induced Cognitive Impairment in Mice: Implication of Caspase-3 Activation. Tropical Journal of Pharmaceutical Research. 2020;19(4):773–780. https://doi.org/10.4314/tjpr.v19i4.14
9. Yang G, Sun X, Wang R. Hydrogen Sulfide‐Induced Apoptosis of Human Aorta Smooth Muscle Cells via the Activation of Mitogen‐Activated Protein Kinases and Caspase‐3. FASEB Journal. 2004;18(14):1782–1784. https://doi.org/10.1096/fj.04-2279fje
10. Kobayashi C, Yaegaki K, Calenic B, Ishkitiev N, Imai T, Ii H, et al. Hydrogen Sulfide Causes Apoptosis in Human Pulp Stem Cells. Journal of Endodontics. 2011;37(4):479–484. https://doi.org/10.1016/j.joen.2011.01.017
11. Ryazantseva NV, Novitsky VV, Starikova EG, Kleptsova LA, Jakushina VD, Kaigorodova EV. Role of Hydrogen Sulfide in the Regulation of Cell Apoptosis. Bulletin of Experimental Biology and Medicine. 2011;151:702–704. https://doi.org/10.1007/s10517-011-1420-y
12. Rodkin S, Nwosu C, Raevskaya M, Khanukaev M, Bekova K, Vasilieva I, et al. The Role of Hydrogen Sulfide in the Localization and Expression of p53 and Cell Death in the Nervous Tissue in Traumatic Brain Injury and Axotomy. International Journal of Molecular Sciences. 2023;24(21):15708. https://doi.org/10.3390/ijms242115708
13. Fletcher PA, Scriven DRL, Schulson MN, Moore EDW. Multi-Image Colocalization and Its Statistical Significance. Biophysical Journal. 2010;99(6):1996–2005. https://doi.org/10.1016/j.bpj.2010.07.006
14. Zhang L-M, Jiang C-X, Liu D-W. Hydrogen Sulfide Attenuates Neuronal Injury Induced by Vascular Dementia Via Inhibiting Apoptosis in Rats. Neurochemical Research. 2009;34:1984–1992. https://doi.org/10.1007/s11064-009-0006-9
15. Mooney SM, Miller MW. Expression of Bcl-2, Bax, and Caspase-3 in the Brain of the Developing Rat. Developmental Brain Research. 2000;123(2):103–117. https://doi.org/10.1016/S0165-3806(00)00081-X
16. Alam M, Alam S, Shamsi A, Adnan M, Elasbali AM, Al-Soud WA, et al. Bax/Bcl-2 Cascade Is Regulated by the EGFR Pathway: Therapeutic Targeting of Non-Small Cell Lung Cancer. Frontiers in Oncology. 2022;12:869672. https://doi.org/10.3389/fonc.2022.869672
17. Luo Y, Yang X, Zhao S, Wei C, Yin Y, Liu T, et al. Hydrogen Sulfide Prevents OGD/R-Induced Apoptosis via Improving Mitochondrial Dysfunction and Suppressing an ROS-Mediated Caspase-3 Pathway in Cortical Neurons. Neurochemistry International. 2013;63(8):826–831. https://doi.org/10.1016/j.neuint.2013.06.004
18. Thayyullathil F, Chathoth S, Hago A, Patel M, Galadari S. Rapid Reactive Oxygen Species (ROS) Generation Induced by Curcumin Leads to Caspase-Dependent and -Independent Apoptosis in L929 Cells. Free Radical Biology and Medicine. 2008;45(10):1403–1412. https://doi.org/10.1016/j.freeradbiomed.2008.08.014
19. Rodkin SV, Nwosu CD. Role of Nitric Oxide and Hydrogen Sulfide in Neuronal and Glial Cell Death in Neurodegenerative Processes. Biologičeskie membrany. 2023;40(5):306–327. https://doi.org/10.31857/S0233475523050067
20. Ye X, Li Y, Lv B, Qiu B, Zhang S, Peng H, et al.. Endogenous Hydrogen Sulfide Persulfidates Caspase-3 at Cysteine 163 to Inhibit Doxorubicin-Induced Cardiomyocyte Apoptosis. Oxidative Medicine and Cellular Longevity. 2022;(1):6153772. https://doi.org/10.1155/2022/6153772
21. Corsello T, Komaravelli N, Casola A. Role of Hydrogen Sulfide in NRF2and Sirtuin-Dependent Maintenance of Cellular Redox Balance. Antioxidants. 2018;7(10):129. https://doi.org/10.3390/antiox7100129
22. Yang G, Zhao K, Ju Y, Mani S, Cao Q, Puukila S, et al. Hydrogen Sulfide Protects Against Cellular Senescence via S-Sulfhydration of Keap1 and Activation of Nrf2. Antioxidants and Redox Signaling. 2013;18(15):1906–1919. https://doi.org/10.1089/ars.2012.4645
23. Huang Y-Q, Jin H-F, Zhang H, Tang C-S, Du J-B. Interaction among Hydrogen Sulfide and Other Gasotransmitters in Mammalian Physiology and Pathophysiology. In: Zhu YC. (Ed.) Advances in Hydrogen Sulfide Biology. Advances in Experimental Medicine and Biology. Vol 1315. Singapore: Springer; 2021. P. 205–236. https://doi.org/10.1007/978981-16-0991-6_9
Об авторах
С. В. РодькинРоссия
Станислав Владимирович Родькин - кандидат биологических наук, доцент кафедры биоинженерии, заведующий лабораторией медицинских цифровых изображений на основе базисной модели.
344003, Ростов-на-Дону, пл. Гагарина, д. 1
Е. Ю. Кириченко
Россия
Кириченко Евгения Юрьевна - доктор биологических наук, профессор, заведующая кафедрой биоинженерии.
344003, Ростов-на-Дону, пл. Гагарина, д. 1
В данном исследовании впервые продемонстрировано влияние сероводорода на каспазу-3 при черепно-мозговой травме. Химическое соединение H₂S снижало уровень каспазы-3, влияя на нейровоспалительный ответ. Эксперимент с ингибитором синтеза H₂S, AOAA, показал обратное увеличение экспрессии этого фермента. Результаты подтверждают значимость H₂S в регуляции клеточной гибели в мозге после травмы. Исследование открывает перспективы для разработки новых нейропротекторных препаратов.
Рецензия
Для цитирования:
Родькин С.В., Кириченко Е.Ю. H₂S-зависимые механизмы экспрессии и локализации каспазы-3 в клетках головного мозга мышей при черепно-мозговой травме. Ветеринарная патология. 2025;24(2):19-28. https://doi.org/10.23947/2949-4826-2025-24-2-19-28. EDN: HPMRMX
For citation:
Rodkin S.V., Kirichenko E.Yu. H₂S-Dependent Mechanisms of Caspase-3 Expression and Localization in Brain Cells of Mice with Traumatic Brain Injury. Russian Journal of Veterinary Pathology. 2025;24(2):19-28. https://doi.org/10.23947/2949-4826-2025-24-2-19-28. EDN: HPMRMX


























