Перейти к:
Доклинические испытания усовершенствованной «Ассоциированной вакцины против ИРТ, ВД-БС, ПГ-3 и хламидиоза крупного рогатого скота инактивированной эмульсионной» на белых мышах и кроликах
https://doi.org/10.23947/2949-4826-2025-24-3-53-64
Аннотация
Введение. Инфекционные респираторно-кишечные болезни крупного рогатого скота являются многофакторными заболеваниями, что обуславливает ассоциированную вирусную или вирусно-бактериальную этиологию течения инфекционного процесса среди различного поголовья продуктивных животных. Борьба с респираторно-кишечными ассоциированными инфекциями крупного рогатого скота ведется в подавляющем большинстве стран мира и требует эффективных мер и препаратов. Целью исследования явились доклинические испытания экспериментальной серии «Ассоциированной вакцины против ИРТ, ВД-БС, ПГ-3 и хламидиоза крупного рогатого скота инактивированной эмульсионной», усовершенствованной за счет расширения спектра хламидийного антигена, на белых мышах и кроликах.
Материалы и методы. Испытания проведены в лаборатории вирусных заболеваний животных ФГБНУ «ФЦТРБ-ВНИВИ» (г. Казань) в период с февраля по ноябрь 2024 г. Были изготовлены два варианта биопрепарата: стандартная ассоциированная вакцина и экспериментальная, в состав хламидийного антигена которой были добавлены штаммы «АМК-16» и «МЗ-89». В качестве лабораторных животных выступили белые мыши и кролики. Вакцины оценивались на стерильность, безвредность, переносимость, антигенную активность, влияние на формирование гуморального противовирусного иммунитета, иммуногенность.
Результаты исследования. Было доказано, что оба варианта ассоциированной вакцины стерильны, безвредны и хорошо переносятся лабораторными животными. Изменение состава хламидийного антигена ассоциированной вакцины не оказало негативного влияния на формирование противовирусного гуморального иммунитета у лабораторных животных. Уровень специфических противохламидийных антител у кроликов, иммунизированных усовершенствованной вакциной, был выше, чем в группе кроликов, привитых препаратом, изготовленным по стандартной методике. Индекс защиты в группе белых мышей, привитых усовершенствованным препаратом, был в 1,3 раза выше, по сравнению со стандартным образцом.
Обсуждение и заключение. На основании полученных данных можно заключить, что усовершенствованная ассоциированная вакцина, как и стандартная, хорошо переносится лабораторными животными. Расширение спектра хламидийного антигена «Ассоциированной вакцины против ИРТ, ВД-БС, ПГ-3 и хламидиоза крупного рогатого скота» дополнительными штаммами не только не оказало негативного эффекта на формирование гуморального противовирусного иммунитета у лабораторных животных, но более того — стимулировало выработку гуморального ответа в отношении хламидийного антигена, способствуя повышению иммуногенности вакцины в 1,3 раза.
Ключевые слова
Для цитирования:
Евстифеев В.В., Акбашев И.Р., Хусаинов Ф.М., Яковлев С.И., Хамидуллина Р.З., Иванова С.В. Доклинические испытания усовершенствованной «Ассоциированной вакцины против ИРТ, ВД-БС, ПГ-3 и хламидиоза крупного рогатого скота инактивированной эмульсионной» на белых мышах и кроликах. Ветеринарная патология. 2025;24(3):53-64. https://doi.org/10.23947/2949-4826-2025-24-3-53-64
For citation:
Evstifeev V.V., Akbashev I.R., Khusainov F.M., Yakovlev S.I., Khamidullina R.Z., Ivanova S.V. Preclinical Trials in White Mice and Rabbits of the Improved “Associated Inactivated Emulsion Vaccine against Infectious Bovine Rhinotracheitis (IBR), Bovine Viral Diarrhea/Mucosal Disease (BVD), Bovine Parainfluenza Virus 3 (BPIV-3) and Chlamydia in Cattle”. Russian Journal of Veterinary Pathology. 2025;24(3):53-64. https://doi.org/10.23947/2949-4826-2025-24-3-53-64
Введение. Инфекционные респираторные и кишечные болезни молодняка крупного рогатого скота (КРС) представляют собой серьезную проблему для животноводческих хозяйств по всей России. В этиологии патологий участвуют, как правило, несколько возбудителей одновременно, представляющие собой устойчивые ассоциации вирусных и бактериальных агентов,
вызывающие различные по проявлению и тяжести течения заболевания [1–3]. Борьба с респираторно-кишечными ассоциированными инфекциями КРС ведется в животноводческой отрасли в подавляющем большинстве стран мира [3–5]. Немаловажным фактором, обуславливающим необходимость усовершенствования способов этой борьбы, а также профилактики
респираторно-кишечных инфекций, является экономическая сторона вопроса: животноводческие комплексы несут огромные финансовые потери в связи с широким распространением ассоциированных инфекций среди поголовья [6, 7].
Возбудители вирусных заболеваний обычно вызывают первичную инфекцию, которая сначала протекает в легкой форме: на этом этапе происходит подавление иммунитета, что впоследствии приводит к повышению восприимчивости к вторичным бактериальным инфекциям [6, 8–10]. Однако в некоторых случаях алгоритм развития инфекционного процесса протекает иначе и в качестве патогена, вызвавшего первичную инфекцию, выступают бактерии, как правило, те, которые способны к длительному персистированию в инфицированном организме, не вызывая при этом ярко выраженных клинических признаков инфекции, например, хламидии [11].
Хламидии — облигатные внутриклеточные паразиты с уникальным двухэтапным циклом развития [12]. Эти микроорганизмы способны инфицировать огромное количество видов животных. Течение инфекционного процесса при хламидиозе даже в разных популяциях одного вида животных обычно не имеет системы [13], что обусловлено эволюционной способностью данного вида микроорганизмов поражать разнообразные системы органов животных, вызывая при этом различные клинические признаки болезни (пневмонии, артриты, конъюнктивиты, энцефалиты и др.). Помимо этого, хламидии способны передаваться от одного вида животных другому, что также играет важную роль в широком распространении этой инфекции среди домашних и диких животных [3, 14].
Наиболее распространенными вирусными патогенами на территории РФ являются возбудители таких инфекций, как инфекционный ринотрахеит (ИРТ), парагрипп-3 (ПГ-3) и вирусная диарея (ВД-БС) [15, 16]. Ранее коллективом ученых Федерального центра токсикологической, радиологической и биологической безопасности (г. Казань) была разработана «Ассоциированная вакцина против инфекционного ринотрахеита, вирусной диареи, болезни слизистых, парагриппа-3 и хламидиоза крупного рогатого скота инактивированная эмульсионная» [16]. Антигенный состав этого биопрепарата включал в себя по одному штамму вирусов ИРТ, ПГ-3, ВД-БС и штамм Chlamydia psittaci «250», выделенный от КРС.
Многолетние прикладные и фундаментальные исследования хламидийных инфекций животных позволили установить, что разные штаммы хламидий одного вида, выделенные при разных патологиях от одного и того же вида животных или от других сельскохозяйственных животных, отличаются друг от друга в антигенном отношении. Эти различия в биохимическом и генетическом строении хламидий напрямую коррелируют с иммуногенностью разных штаммов по отношению друг к другу [17]. Также установлен факт наличия у хламидий способности к горизонтальному переносу генов среди разных видов этого возбудителя, благодаря чему некоторые штаммы хламидий в своем биохимическом составе могут содержать некоторые антигенные эпитопы, специфичные для других видов этого патогена [18].
Ранее нами были изучены антигенные и иммуногенные свойства разных штаммов хламидий, выделенных на территориях различных субъектов РФ [17, 19, 20]. В ходе исследований нами была сконструирована новая антигенная композиция, состоящая из трех наиболее иммуногенных и отличающихся в антигенном отношении штаммов хламидий, выделенных от разных видов животных. Помимо этого, после полногеномного секвенирования и последующего биоинформационного анализа нуклеотидной последовательности хромосомы одного из штаммов, входящих в новую антигенную композицию, было установлено, что этот штамм содержит антигенные эпитопы, специфичные сразу к двум видам хламидий — Chlamydia psittaci и Chlamydia abortus [21]. В связи с этим, перспективно было применить в составе ассоциированной вакцины новую композицию хламидийного антигена, включающую три штамма хламидий, что и было сделано.
Таким образом, в состав «Ассоциированной вакцины против ИРТ, ВД-БС, ПГ-3 и хламидиоза крупного рогатого скота инактивированной эмульсионной» были включены антигены еще двух штаммов хламидий — «АМК-16» (возбудитель артрита и аборта коз) и «МЗ-89» (возбудитель менингоэнцефалита телят). При этом количественное соотношение антигенов разных видов возбудителей в составе вакцины осталось прежним. Доклинические испытания на лабораторных животных имели целью выяснить, как повлияло изменение композиции хламидийного антигена на свойства «Ассоциированной вакцины против ИРТ, ВД-БС, ПГ-3 и хламидиоза крупного рогатого скота инактивированной эмульсионной».
Материалы и методы. Исследование проводили на базе лаборатории вирусных заболеваний животных ФГБНУ «ФЦТРБ-ВНИВИ» (г. Казань) в период с февраля по ноябрь 2024 г.
Штаммы. Использовались следующие штаммы вирусов и хламидий:
– штамм «ВК-1» вируса ВД-БС, инфекционный титр 10-6,87ТЦД50/ ml;
– вакцинный штамм «ТК-А (ВИЭВ)-В-2» вируса ИРТ крупного рогатого скота;
– референтный штамм «ПТК-45/86» вируса ПГ-3 крупного рогатого скота;
– штамм Chlamydia psittaci «АМК-16», выделенный из патологического материала абортировавшей козы;
– штамм Chlamydia psittaci «250», выделенный из патологического материала абортировавшей коровы;
– штамм Chlamydia psittaci «МЗ-89», выделенный из мозга теленка при энцефалитной форме течения хламидийной инфекции;
– штамм Chlamydia psittaci «РС-85», выделенный из патологического материала абортировавшей свиньи.
Питательные среды. Стерильность биопрепаратов оценивали путем их высева на питательные среды: мясопептонный агар (МПА); мясопептонный бульон (МПБ); мясопептонный печеночный бульон и среду Сабуро. Для культивирования и поддержания культуры клеток использовались следующие питательные среды: синтетическая среда 199; сбалансированный раствор Хэнкса; эмбриональная сыворотка крупного рогатого скота, изготовленная ВНИВИ; среда Игла МЕМ (Minimum Essential Medium) с глутамином, рН 7,5–7,6.
Культуры клеток. Культивирование вирусов осуществляли на перевиваемой культуре клеток почки быка «MDBK».
Биологические модели. Биомассу хламидий получали путем заражения куриных эмбрионов штаммами хламидий в желточный мешок.
Лабораторные животные. Белые мыши и кролики.
В ходе проведения экспериментальных манипуляций с животными были соблюдены требования Директивы 2010/63/EU Европейского парламента и Совета Европейского союза от 22.09.2010 по охране животных, используемых в научных целях. Животные содержались в оптимальных условиях, имели свободный доступ к кормам и воде.
Реактивы и тест-системы. Серологические исследования проводили с применением следующих диагностических тест-систем:
– «Набор антигенов и сывороток для серологической диагностики хламидиозов сельскохозяйственных животных» (РОСС RU.ФВ01.Н00022) производства ФГБНУ «ФЦТРБ-ВНИВИ» (г. Казань);
– «Набор для диагностики парагриппа-3 крупного рогатого скота» (ФКП «Курская биофабрика – Фирма «БИОК»);
– «Набор для выявления антител к вирусу инфекционного ринотрахеита крупного рогатого скота иммуноферментным методом «ИРТ-СЕРОТЕСТ» (ООО «Ветбиохим», г. Москва);
– «Набор для иммуноферментной диагностики вирусной диареи – болезни слизистых (ВД-БС) крупного рогатого скота» (ВИЭВ, г. Москва).
Состав вакцин. Для проведения исследования были изготовлены два различных по антигенному составу варианта ассоциированной вакцины. Первая (стандартная) серия биопрепарата включала в себя штаммы
вирусов: ПГ-3 — «ПТК-45/86», ВД-БС — «ВК-1»,
ИРТ — «ТК-А (ВИЭВ)-В-2» и хламидий — «250». При изготовлении второй (экспериментальной) серии вакцины использовались аналогичные штаммы вирусов, а в состав хламидийного антигена были добавлены еще два штамма — «АМК-16» и «МЗ-89». Количество антигенов всех штаммов в хламидийном антигене находились в равных пропорциях. В готовых обоих вариантах вакцины антигены вирусов и хламидий были представлены в равном соотношении: ПГ-3, ИРТ, ВД-БС и хламидии в пропорции 1:1:1:1. В качестве вспомогательного компонента при создании каждой серии вакцины использовали масло-ланолиновый адъювант (МЛА). Эмульсия вакцины представляла собой систему вода-масло.
Методы. Определение стерильности вакцин проводили в соответствии с «ОФС 1.2.4.0003.15 Общая фармакопейная статья. Стерильность» (п. 2.3) методом прямого посева.
Определение безвредности экспериментальных препаратов проводили в соответствии с ГОСТ 31926. Для каждой серии вакцины были сформированы группы по 15 белых мышей в возрасте от 2 до 3 месяцев с живой массой от 18 до 25 г. Подготовленные пробы исследуемых препаратов вводили животным внутрибрюшинно, в объеме 0,25 см3. Далее, на протяжении 10 суток после введения вакцины, проводили ежедневные клинические осмотры привитых животных с целью выявления больных или павших особей. Вакцина считалась безвредной, если на протяжении всего срока наблюдения за животными у них не выявляли ухудшение общего состояния или не фиксировали случаи гибели.
Для оценки переносимости и антигенной активности вакцин 12 кроликов были разделены на три группы по 4 особи в каждой. Первую группу животных иммунизировали стандартной серией вакцины, вторую — экспериментальной. Животные третьей группы вакцинации не подвергались и являлись контролем. Биопрепараты животным вводили внутримышечно в область бедра в объеме 0,5 см3.
При оценке переносимости вакцин кроликами учитывали следующие показатели:
– общее состояние животных;
– общая температура тела после иммунизации;
– наличие местной реакции на месте введения вакцины;
– изменения аппетита после иммунизации;
– поведенческие реакции.
Оценка переносимости вакцин проводилась в течение первых 10 суток после иммунизации. Ежедневно, в ходе проведения клинических осмотров животных, фиксировались и учитывались вышеперечисленные показатели. Общая температура тела измерялась при помощи медицинского ртутного термометра. Общее состояние оценивали визуально, основное внимание обращали на позы животных, их шерстный покров
и походку. Об аппетите животных судили по наличию или отсутствию корма в кормушках после кормления. О переносимости вакцин судили по отсутствию местной и общей реакции животных на введение биопрепарата.
Оценку антигенной активности вакцин проводили при помощи серологических реакций. Для этого у исследуемых животных систематически в течение 6 месяцев (на 30-е, 60-е, 90-е и 180-е сутки после вакцинации) отбирались пробы сывороток крови. Концентрация антител, специфичных к вирусу ПГ-3, определялась в реакции торможения гемагглютинации (РТГА). Уровень противохламидийных антител в сыворотках крови иммунизированных животных определяли путем постановки реакции связывания комплемента (РСК). Специфические антитела к вирусам ИРТ и ВД-БС определялись при помощи иммуноферментного анализа (ИФА).
Способность вакцин вызывать выработку противохламидийного иммунитета у иммунизированных животных определяли в остром опыте на белых мышах (n=180). Для каждой серии вакцины были сформированы по четыре опытные (всего 8 опытных групп) и четыре контрольные группы лабораторных животных по 15 особей в каждой. Животным опытных групп вводили исследуемые препараты подкожно в объеме 0,2 см3. На 30-е сутки после иммунизации животные всех групп были заражены различными штаммами хламидий. Первые опытные группы мышей заражали штаммом «АМК-16», вторые — «РС-85», третьи — «250», четвертые — «МЗ-89». Контрольные группы были инфицированы аналогичным способом.
Об иммуногенности биопрепаратов судили по индексу защиты, который вычисляли по формуле:
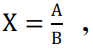 (1)
(1)
где Х — индекс защиты; А — количество павших животных в контрольных группах; В — количество павших животных в иммунизированных группах.
Для подтверждения хламидийной этиологии гибели инфицированных мышей проводили исследование мазков-отпечатков под иммерсионной системой светового микроскопа (Nikon Eclipse, Япония). Мазки-отпечатки готовили из внутренних органов павших животных и окрашивали по модифицированному методу Стемпа.
Результаты исследования. Высевом проб двух вакцин (усовершенствованной и стандартной) на питательные среды МПА, МПБ, МППБ и Сабуро было установлено отсутствие роста микрофлоры на питательных средах в течение срока наблюдения, что подтверждало стерильность исследуемых препаратов.
Введение экспериментального и стандартного образцов вакцин белым мышам не вызвало у них никаких побочных реакций и негативных патологических процессов в течение срока наблюдений, что указывало на безвредность препаратов.
Наблюдения за иммунизированными и интактными кроликами в ходе изучения переносимости вакцин показали, что на протяжении всего срока исследования средняя температура тела животных двух опытных, вакцинированных разными вариантами ассоциированной вакцины, и контрольной групп практически не изменялась и находилась в пределах от плюс 38,8 ºС до плюс 39,0 ºС. Все изучаемые показатели находились в пределах физиологической нормы.
При проведении ежедневных клинических осмотров иммунизированных кроликов патологических состояний выявлено не было. Общее состояние животных было удовлетворительным, аппетит сохранен, аномальные поведенческие реакции отсутствовали. На месте введения биопрепаратов у животных опытных групп наблюдалась небольшая припухлость, которая рассасывалась в течение 10–15 суток после прививки, что допустимо при иммунизации эмульсионными вакцинами.
Для определения влияния на формирование поствакцинального гуморального иммунитета были проведены серологические исследования, в ходе которых установлен уровень специфических антител к антигенам, использованным в составе экспериментальной и стандартной вакцин, в крови кроликов в разные сроки после иммунизации. Результаты серологических исследований представлены в таблице 1.
Из данных таблицы 1 видно, что вакцинация кроликов обоими вариантами биопрепаратов вызвала у них выработку как противовирусных, так и противохламидийных антител. На 30-е сутки после вакцинации уровень иммуноглобулинов, специфичных к вирусу парагриппа-3 у животных, иммунизированных стандартным препаратом, варьировался в пределах титров от 1:80 до 1:320. У всех кроликов, иммунизированных экспериментальным препаратом, на этот срок исследования титры антител к вирусу ПГ-3 были равны 1:160. Средние титры иммуноглобулинов к вирусу ПГ-3 в двух группах были равны титру 1:160. Концентрация противовирусных антител, специфичных к вирусу инфекционного ринотрахеита, в двух группах на 30-е сутки исследования находилась в пределах титров от 1:400 до 1:1600.
Также не было выявлено значительной разницы в формировании гуморального иммунитета к вирусу ВД-БС. На 30-е сутки исследования иммуноглобулины, специфичные к этому вирусу, находились в пределах титров от 1:800 до 1:1600. Небольшая разница была выявлена на 30-е сутки после вакцинации при формировании гуморального противохламидийного иммунитета. В группе, иммунизированной стандартным препаратом, у всех животных концентрация комплементсвязывающих иммуноглобулинов находилась на уровне, равном титру 1:20. В группе животных, иммунизированных экспериментальным препаратом, средний титр антител был несколько выше и равнялся титру 1:30.
Таблица 1
Испытания антигенной активности стандартного и экспериментального вариантов «Ассоциированной вакцины против ИРТ, ВД-БС, ПГ-3 и хламидиоза крупного рогатого скота» на кроликах
|
Антиген / Тест |
Вариант вакцины |
Номер животного |
Титры антител |
|||
|
30-е сутки |
60-е сутки |
90-е сутки |
180-е сутки |
|||
|
ПГ-3 /РТГА |
Стандарт |
1 |
1:80 |
1:1280 |
1:1280 |
1:1280 |
|
2 |
1:80 |
1:640 |
1:1280 |
1:1280 |
||
|
3 |
1:160 |
1:640 |
1:640 |
1:640 |
||
|
4 |
1:320 |
1:640 |
1:2560 |
1:2560 |
||
|
Средний титр |
1:160 |
1:800 |
1:1440 |
1:1440 |
||
|
Эксперимент |
1 |
1:160 |
1:1280 |
1:1280 |
1:1280 |
|
|
2 |
1:160 |
1:1280 |
1:2560 |
1:2560 |
||
|
3 |
1:160 |
1:640 |
1:1280 |
1:640 |
||
|
4 |
1:160 |
1:320 |
1:1280 |
1:640 |
||
|
Средний титр |
1:160 |
1:880 |
1:1600 |
1:1280 |
||
|
ИРТ/ ИФА |
Стандарт |
1 |
1:1600 |
1:3200 |
1:6400 |
1:6400 |
|
2 |
1:400 |
1:3200 |
1:3200 |
1:3200 |
||
|
3 |
1:800 |
1:1600 |
1:6400 |
1:3200 |
||
|
4 |
1:800 |
1:1600 |
1:6400 |
1:6400 |
||
|
Средний титр |
1:900 |
1:2400 |
1:5600 |
1:4800 |
||
|
Эксперимент |
1 |
1:400 |
1:400 |
1:1600 |
1:1600 |
|
|
2 |
1:400 |
1:1600 |
1:6400 |
1:3200 |
||
|
3 |
1:1600 |
1:3200 |
1:6400 |
1:6400 |
||
|
4 |
1:1600 |
1:3200 |
1:6400 |
1:6400 |
||
|
Средний титр |
1:1000 |
1:2100 |
1:5200 |
1:4400 |
||
|
ВД-БС/ ИФА
|
Стандарт |
1 |
1:1600 |
1:6400 |
1:6400 |
1:3200 |
|
2 |
1:1600 |
1:1600 |
1:3200 |
1:6400 |
||
|
3 |
1:800 |
1:800 |
1:1600 |
1:1600 |
||
|
4 |
1:800 |
1:1600 |
1:3200 |
1:1600 |
||
|
Средний титр |
1:1200 |
1:2600 |
1:3600 |
1:3200 |
||
|
Эксперимент |
1 |
1:800 |
1:1600 |
1:3200 |
1:800 |
|
|
2 |
1:1600 |
1:3200 |
1:3200 |
1:3200 |
||
|
3 |
1:1600 |
1:3200 |
1:6400 |
1:6400 |
||
|
4 |
1:800 |
1:800 |
1:1600 |
1:1600 |
||
|
Средний титр |
1:1200 |
1:2200 |
1:3600 |
1:3000 |
||
|
Хламидиоз/ РСК |
Стандарт |
1 |
1:20 |
1:20 |
1:80 |
1:80 |
|
2 |
1:20 |
1:20 |
1:40 |
1:40 |
||
|
3 |
1:20 |
1:20 |
1:80 |
1:80 |
||
|
4 |
1:20 |
1:40 |
1:40 |
1:40 |
||
|
Средний титр |
1:20 |
1:20 |
1:60 |
1:60 |
||
|
Эксперимент |
1 |
1:20 |
1:40 |
1:80 |
1:80 |
|
|
2 |
1:40 |
1:80 |
1:160 |
1:80 |
||
|
3 |
1:20 |
1:20 |
1:80 |
1:80 |
||
|
4 |
1:40 |
1:40 |
1:80 |
1:80 |
||
|
Средний титр |
1:30 |
1:45 |
1:100 |
1:80 |
||
Следует отметить, что самая низкая концентрация как противовирусных, так и противохламидийных иммуноглобулинов, была выявлена на 30-е сутки после вакцинации. В течение двух последующих месяцев в сыворотках крови иммунизированных животных наблюдали увеличение концентрации антител, специфичных ко всем антигенам, входящим в состав ассоциированной вакцины. Так, на 90-е сутки к вирусу ПГ-3 в РТГА были установлены средние титры антител на уровне 1:1440 и 1:1600 к стандартному и экспериментальному вариантам вакцины соответственно. Средние титры специфических антител к вирусу ИРТ в ИФА в этот промежуток времени находились в пределах титров 1:5600 для стандартного образца вакцины и 1:5200 для экспериментального. К вирусу ВД-БС на 90-е сутки после вакцинации средние титры противовирусных антител в обеих группах равнялись титру 1:3600.
Несколько иная картина наблюдалась при исследовании сывороток крови с хламидийным антигеном, где была выявлена существенная разница между уровнем антител в двух группах вакцинированных кроликов. Так, средний титр антител в РСК с хламидийным
антигеном в группе животных, вакцинированных стандартным образцом биопрепарата, был равен 1:60, в то время как в группе лабораторных животных, иммунизированных экспериментальным препаратом, средний титр был выше и составил 1:100. Следует отметить, что такая картина наблюдалась и в другие сроки исследования, на 60-е и 180-е сутки.
К 180-м суткам концентрация противовирусных и противохламидийных антител в сыворотках крови иммунизированных животных начала снижаться в обеих группах, но всё равно в экспериментальной группе она была выше. При этом существенная разница между уровнем антител к специфическим антигенам по группам не выявлялась за исключением хламидийного антигена, к которому более высокий уровень антител выявлялся в группе животных, вакцинированных экспериментальным вариантом.
На рис. 1, 2, 3 и 4 представлена динамика средних титров специфических антител к вирусным и хламидийным антигенам в течение всего срока наблюдений за животными (для наглядности — отдельно по каждому антигену).
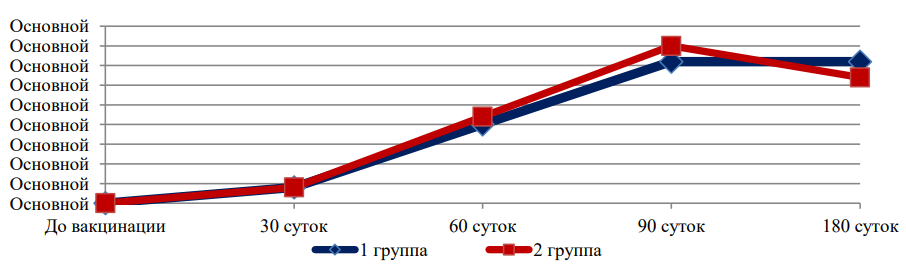
Рис. 1. Средние титры противовирусных антител, специфичных к возбудителю ПГ-3
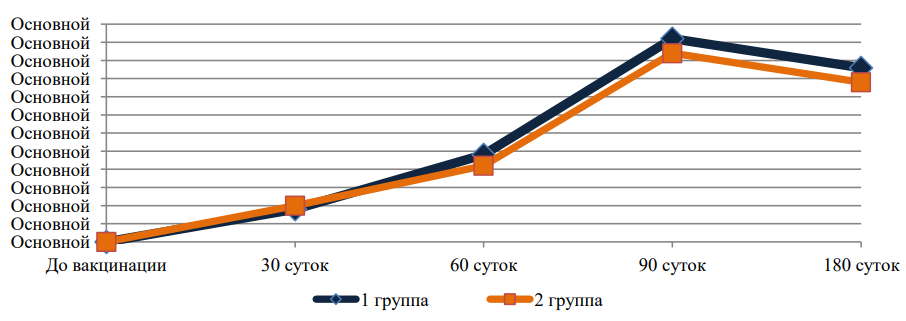
Рис. 2. Средние титры противовирусных антител, специфичных к возбудителю ИРТ
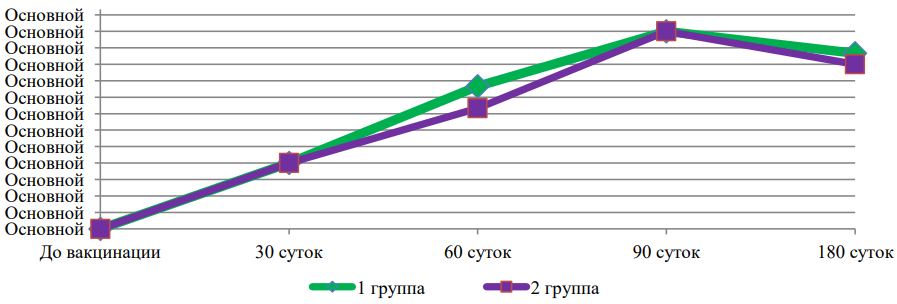
Рис. 3. Средние титры противовирусных антител, специфичных к возбудителю ВД-БС
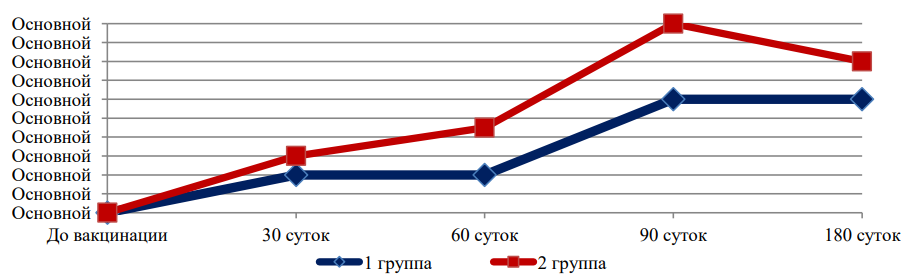
Рис. 4. Средние титры противохламидийных антител
Представленные данные (рис. 1, 2, 3 и 4) свидетельствуют о том, что изменение состава хламидийного антигена в ассоциированной вакцине не оказало негативного влияния на формирование гуморального противовирусного иммунитета, но позволило повысить выработку специфических противохламидийных антител в сыворотках крови иммунизированных животных.
Для определения влияния на иммуногенность усовершенствованной вакцины был проведен острый опыт на лабораторных белых мышах. Первую и вторую группы животных иммунизировали модифицированной вакциной и стандартным образцом соответственно. Далее проводили заражение всех групп животных четырьмя производственными штаммами хламидий. Результаты этих исследований представлены в таблице 2.
Таблица 2
Исследование иммуногенности стандартного и экспериментального образцов вакцин в остром опыте на белых мышах
|
Номер серии вакцины для иммунизации |
Штамм для заражения |
Количество павших животных |
Количество выживших животных |
Индекс защиты |
|
Стандарт |
«250» |
4 |
11 |
3,5 |
|
«РС-85» |
3 |
12 |
4,3 |
|
|
«АМК-16» |
4 |
11 |
3,75 |
|
|
«МЗ-89» |
3 |
12 |
4,7 |
|
|
Всего по группам |
14 |
46 |
4 |
|
|
Эксперимент |
«250» |
3 |
12 |
4,7 |
|
«РС-85» |
2 |
13 |
6,5 |
|
|
«АМК-16» |
2 |
13 |
7,5 |
|
|
«МЗ-89» |
2 |
13 |
7 |
|
|
Всего по группам |
9 |
51 |
6,2 |
|
|
Контроль |
«250» |
14 |
1 |
– |
|
«РС-85» |
13 |
2 |
– |
|
|
«АМК-16» |
15 |
– |
– |
|
|
«МЗ-89» |
14 |
1 |
– |
|
|
Всего по группам |
56 |
4 |
– |
|
Как видно из таблицы 2, из 60 мышей, иммунизированных стандартной вакциной, после заражения четырьмя штаммами хламидий выжило 46 особей. Индексы защиты в группах белых мышей после инфицирования возбудителями хламидиоза находились в пределах показателей от 3,5 до 4,7. Средний индекс защиты по четырем группам белых мышей, вакцинированных стандартным препаратом, был равен 4.
В группах мышей, иммунизированных усовершенствованной ассоциированной вакциной, количество выживших животных было значительно выше (51 особь). Индексы защиты при заражении разными штаммами хламидий находились в пределах показателей от 4,7 до 7,5. Средний индекс защиты по всем группам, зараженным разными штаммами хламидий и вакцинированных усовершенствованным препаратом, был равен 6,2, что в 1,3 раза выше по сравнению со стандартным образцом.
В контрольных группах после заражения вирулентной культурой хламидий разных штаммов в живых осталось только 4 (6,7 %) из 60 белых мышей.
Обсуждение и заключение. Данные, полученные в ходе доклинических испытаний усовершенствованной «Ассоциированной вакцины против ИРТ, ВД-БС, ПГ-3 и хламидиоза крупного рогатого скота инактивированной эмульсионной», позволяют утверждать, что она переносится лабораторными животными так же хорошо, как и стандартная. Изменение состава хламидийного антигена препарата не оказывает негативного эффекта на формирование гуморального противовирусного иммунитета у лабораторных животных, напротив, добавление в состав вакцины двух штаммов хламидий стимулирует выработку гуморального ответа в отношении хламидийного антигена и в 1,3 раза повышает иммуногенность вакцины по сравнению со стандартным образцом.
Список литературы
1. Murray GM, Cassidy JP, Clegg TA, Tratalos JA, McClure J, O’Neill RG, et al. A Retrospective Epidemiological Analysis of Risk Factors for a Primary Necropsy Diagnosis of Bovine Respiratory Disease. Preventive Veterinary Medicine. 2016;132:49–56. https://doi.org/10.1016/j.prevetmed.2016.08.009
2. Callaby R, Toye P, Jennings A, Thumbi SM, Coetzer JA, Conradie Van Wyk IC, et al. Seroprevalence of Respiratory Viral Pathogens of Indigenous Calves in Western Kenya. Research in Veterinary Science. 2016;108:120–124. https://doi:10.1016/j.rvsc.2016.08.010
3. Притыченко А.В., Красочко И.А. Иммуногенность инактивированной ассоциированной вакцины против вирусных респираторных инфекций крупного рогатого скота. В: Материалы Международной научно-практической конференции, посвященной Дню Белорусской науки и 95-летию кафедры эпизоотологии и инфекционных болезней. Витебск; 2023. С. 95–97.
4. Murray GM, O'Neill RG, More SJ, McElroy MC, Earley B, Cassidy JP. Evolving Views on Bovine Respiratory Disease: An Appraisal of Selected Control Measures – Part 2. The Veterinary Journal. 2016;217:78–82. https://doi.org/10.1016/j.tvjl.2016.09.013
5. Bell RL, Turkington HL, Cosby SL. The Bacterial and Viral Agents of BRDC: Immune Evasion and Vaccine Developments. Vaccines. 2021;9(4):337. https://doi.org/10.3390/vaccines9040337
6. Grissett GP, White BJ, Larson, RL. Structured Literature Review of Responses of Cattle to Viral and Bacterial Pathogens Causing Bovine Respiratory Disease Complex. Journal of Veterinary Internal Medicine. 2015;29(3):770–780. https://doi.org/10.1111/jvim.12597
7. Brodersen BW, Kelling CL. Effect of Concurrent Experimentally Induced Bovine Respiratory Syncytial Virus and Bovine Viral Diarrhea Virus Infection on Respiratory Tract and Enteric Diseases in Calves. American Journal of Veterinary Research. 1998;59(11):1423–1430.
8. Woolums AR, Ames TR, Baker JC. The Bronchopneumonias (Respiratory Disease Complex of Cattle, Sheep, and Goats). In: Large Animal Internal Medicine; Louis, MO: Mosby Elsevier; 2015. P. 584–603.
9. Красочко П.А., Красочко П.П., Иващенко И.А. Изучение безвредности различных вариантов ассоциированной вирусно-бактериальной вакцины. В: Материалы Международной научно-практической конференции, посвященной 95-летию со дня рождения доктора ветеринарных наук, профессора Смирновой Нины Ивановны и Дню белорусской науки. Витебская государственная академия ветеринарной медицины: Витебск; 2024. С. 79–84.
10. Глотов А.Г., Глотова Т.И., Нефедченко А.В. Этиологическая структура массовых респираторных болезней молодняка крупного рогатого скота в хозяйствах, занимающихся производством молока. Сибирский вестник сельскохозяйственной науки. 2008;(3(183)):72–78.
11. Федорова В.А., Ляпина А.М., Хижнякова М.А., Зайцев С.С., Салтыков Ю.В., Субботина И.А. и др. Хламидиозы животных и человека. Москва: Наука; 2019. 135 с.
12. Мустафаева Н.А., Сафарова С.А., Джумшудова Ф.А. Бабанлы Л.Т., Мамедова М.A. Хламидиоз сельскохозяйственных животных. Прикаспийский вестник ветеринарии. 2023;(1(2)):24–28.
13. Равилов А.З., Гаффаров Х.З., Равилов Р.Х. Хламидиоз животных. Монография. Казань: Издательство «Фэн» Академии наук Республики Татарстан, 2004. 368 с.
14. Borel N, Sachse K. Zoonotic Transmission of Chlamydia Spp.: Known for 140 Years, but Still Underestimated. In book: Sing A. (Ed.) Zoonoses: Infections Affecting Humans and Animals. Cham: Springer; 2023. P. 1–28. https://doi.org/10.1007/978-3-030-85877-3_53-1
15. Акбашев И.Р. Усовершенстование средств специфической профилактики вирусно-хламидийных инфекций крупного рогатого скота. Дис. канд. ветеринар. наук. Казань; 2021. 129 с.
16. Евстифеев В.В., Гумеров В.Г., Хусаинов Ф.М. Каримуллина И.Г., Акбашев И.Р., Яковлев С.И. и др. Разработка ассоциированной вакцины против ИРТ, ПГ-3, ВД-БС и хламидиоза крупного рогатого скота. Ветеринарный врач. 2020;(6):21–28. https://doi.10.33632/1998-698X.2020-6-21-28
17. Яковлев С.И. Усовершенствование средств специфической профилактики хламидиоза животных. Дис. канд. ветеринар. наук. Москва; 2022. 138 с.
18. Feodorova VA, Zaitsev SS, Khizhnyakova MA, Saltykov YuV, Evstifeev VV, Khusainov FM, et al. Data of de Novo Genome Assembly of the Chlamydia Psittaci Strain Isolated from the Livestock in Volga Region, Russian Federation. Data Brief; 2020;29:105190. https://doi.10.1016/j.dib.2020.105190
19. Евстифеев В.В. Разработка и усовершенствование биологических препаратов для диагностики и специфической профилактики хламидиоза животных. Дис. доктор. биолог. наук. Казань; 2015. 417 с.
20. Zaitsev S, Khizhnyakova M, Saltykov Yu, Evstifeev V, Khusainov F, Ivanova S, et al. Complete Genome Sequence of Chlamydia Psittaci АМК-16, Isolated from a Small Ruminant in the Middle Volga Region, Russia. Microbiology Resource Announcements: 2024;13(5):e0054323. https://doi.10.1128/mra.00543-23
21. Feodorova VA, Zaitsev SS, Lyapina AM, Kichemazova NV, Saltykov YuV, et al. Whole Genome Sequencing Characteristics of Chlamydia Psittaci Caprine AMK-16 Strain, a Promising Killed Whole Cell Veterinary Vaccine Candidate against Chlamydia Infection. PLoS ONE. 2023;18(10):e0293612. (In Russ.) https://doi.10.1371/journal.pone.0293612
Об авторах
В. В. ЕвстифеевРоссия
Виталий Валерьевич Евстифеев, доктор биологических наук, доцент, главный научный сотрудник лабора-тории хламидийных инфекций; профессор кафедры микробиологии, вирусологии и иммунологии
420075, Республика Татарстан, г. Казань, Научный городок, д. 2
420029, Республика Татарстан, г. Казань, ул. Си-бирский Тракт, д. 35
И. Р. Акбашев
Россия
Ильгизар Расилович Акбашев, кандидат ветеринарных наук, научный сотрудник лаборатории хламидий-ных инфекций
420075, Республика Татарстан, г. Казань, Научный городок, д. 2
Ф. М. Хусаинов
Россия
Фидаиль Миннигалеевич Хусаинов, доктор ветеринарных наук, доцент, ведущий научный сотрудник лаборатории хламидийных инфекций
420075, Республика Татарстан, г. Казань, Научный городок, д. 2
С. И. Яковлев
Россия
Сергей Игоревич Яковлев, кандидат ветеринарных наук, научный сотрудник лаборатории хламидийных инфекций
420075, Российская Федерация, Республика Татар-стан, г. Казань, Научный городок, д. 2
Р. З. Хамидуллина
Россия
Разина Зиннатулловна Хамидуллина, младший научный сотрудник лаборатории хламидийных инфекций
420075, Республика Татарстан, г. Казань, Научный городок, д. 2
С. В. Иванова
Россия
Светлана Викторовна Иванова, кандидат ветеринарных наук, ведущий научный сотрудник лаборатории хламидийных инфекций
420075, Республика Татарстан, г. Казань, Научный городок, д. 2
В данном исследовании впервые проведены доклинические испытания усовершенствованной ассоциированной вакцины против ИРТ, ВД-БС, ПГ-3 и хламидиоза крупного рогатого скота с расширенным спектром хламидийного антигена. Добавление штаммов хламидий «АМК-16» и «МЗ-89» не оказало негативного влияния на формирование противовирусного иммунитета, но повысило выработку специфических противохламидийных антител. Индекс защиты у мышей, иммунизированных усовершенствованным препаратом, был в 1,3 раза выше по сравнению со стандартной вакциной. Результаты подтверждают, что модификация состава вакцины усиливает её иммуногенность без ухудшения переносимости. Исследование демонстрирует перспективность применения усовершенствованной вакцины для профилактики ассоциированных респираторно-кишечных инфекций у крупного рогатого скота.
Рецензия
Для цитирования:
Евстифеев В.В., Акбашев И.Р., Хусаинов Ф.М., Яковлев С.И., Хамидуллина Р.З., Иванова С.В. Доклинические испытания усовершенствованной «Ассоциированной вакцины против ИРТ, ВД-БС, ПГ-3 и хламидиоза крупного рогатого скота инактивированной эмульсионной» на белых мышах и кроликах. Ветеринарная патология. 2025;24(3):53-64. https://doi.org/10.23947/2949-4826-2025-24-3-53-64
For citation:
Evstifeev V.V., Akbashev I.R., Khusainov F.M., Yakovlev S.I., Khamidullina R.Z., Ivanova S.V. Preclinical Trials in White Mice and Rabbits of the Improved “Associated Inactivated Emulsion Vaccine against Infectious Bovine Rhinotracheitis (IBR), Bovine Viral Diarrhea/Mucosal Disease (BVD), Bovine Parainfluenza Virus 3 (BPIV-3) and Chlamydia in Cattle”. Russian Journal of Veterinary Pathology. 2025;24(3):53-64. https://doi.org/10.23947/2949-4826-2025-24-3-53-64


























